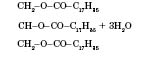- •1)Дати загальну характеристику неметалічніх елементів. Пояснити явище алотропії а конкретних прикладах. Розкрити хімічні властивості неметалів.
- •2)Оксиди неметалів, їх хімічний характер і властивості.
- •3)Сполуки неметалів з гідрогеном. Амоніак, його властивості і застосування.
- •4)Сульфатна кислота, її властивості , якісна реакція на сульфат-йон.
- •5)Нітратна кислота, нітрати, вплив нітратів на живі організми.
- •6)Ортофосфатна кислота, поняття про мінеральні добрива.
- •7)Особливості карбонатної кислоти, значення карбонатів, твердість води і методи її усунення.
- •8)Загальна характеристика металів,їх поширення в природі, практичне застосування. Поняття про корозію.
- •Понятие о коррозии металлов
- •9)Металічний зв’язок , фізичні і хімічні властивості металів.
- •10)Лужні і лужноземельні метали, їх біологічна роль, практичне застосування.
- •11)Алюміній як амфотерний метал, властивості його оксиду і гідроксиду, практичне застосування алюмінію.
- •12)Ферум як метал побічних підгруп, його будова, властивості, застосування.
- •13)Роль металів і сплавів в сучасній техниці.
- •14)Теорія будови органічних сполук о.М.Бутлерова, явище ізомерії.
- •15)Причини багатоманітності і різноманітності органічних сполук.
- •16)Вуглеводні: алкани, алкени алкіни, дієни, Їх будова, номенклатура, властивості, застосування.
- •Гомологи метану
- •17)Природні джерела вуглеводнів: нафта, природний газ. Способи переробки нафти.
- •18)Оксигеновмісні органічні сполуки: спирти, альдегіди , карбонові кислоти, естери. Їх хімічна будова, функціональна група, номенклатура, властивості, застосування.
- •19)Жири як естери, їх склад, фізичні і хімічні властивості, біологічне значення, практичне застосування.
- •20)Вуглеводи: їх склад, будова, біологічні функції, застосування.
- •21)Нітрогеновмісні органічні сполуки: аміни, амінокислоти. Здатність амінокислот утворювати поліпептиди.
- •22)Білки: їх склад, просторова будова, фізичні властивості, біологічні функції, практичне застосування.
- •23)Методи якісного визначення білків.
- •24)Полімерні матеріали, пластмаси. Полімерні матеріали
- •25)Хімія і їжа, вітаміни, харчові добавки.
- •26)Роль хімії в медицині.
- •27)Хімія та побут: побутові хімікати.
18)Оксигеновмісні органічні сполуки: спирти, альдегіди , карбонові кислоти, естери. Їх хімічна будова, функціональна група, номенклатура, властивості, застосування.
І) Спирти. Феноли. Альдегіди
Спирти — це органічні сполуки, до складу яких входить одна або декілька гідроксильних груп (гідроксигруп), сполучених з вуглеводневим радикалом.
Гідроксигрупа –ОН називається функціональною групою, оскільки вона зумовлює основні хімічні властивості спиртів.
У насичених одноатомних спиртів усі карбонові зв’язки ординарні і лише один атом Гідрогену заміщений гідроксигрупою. Назви спиртів утворюються від назв відповідних вуглеводнів з додаванням суфікса -ол (наприклад етанол). Існують також тривіальні назви (наприклад етиловий спирт).
Представники гомологічного ряду насичених одноатомних спиртів
Молекулярна формула |
Назва за міжнародною систематичною номенклатурою |
Тривіальна назва |
Молекулярна формула |
Назва за міжнародною систематичною номенклатурою |
Тривіальна назва |
|
Метанол |
Метиловий спирт |
|
Метанол |
Метиловий спирт |
|
Етанол |
Етиловий спирт |
|
Етанол |
Етиловий спирт |
|
Пропанол |
Пропіловий спирт |
|
Пропанол |
Пропіловий спирт |
Загальна
формула насичених одноатомних спиртів:![]() ;
;![]() ,
де R — вуглеводневий радикал, або
,
де R — вуглеводневий радикал, або![]()
Ізомерія спиртів зумовлена будовою карбонового скелета й положенням функціональної групи.
При складанні назви ізомеру нумерація атомів Карбону починається з того кінця карбон-карбонового ланцюга, до якого ближча функціональна група. Номер атома Карбону, при якому знаходиться гідроксигрупа, указується в кінці назви спирту. Положення вуглеводневого радикала вказується на початку назви. Наприклад:
![]()
4-метилпентанол-2 (але не 2-метилпентанол-4)
Фізичні
властивості спиртів. Спирти з числом
атомів Карбону до 15 — рідини, інші —
тверді речовини. Метанол і етанол —
безбарвні рідини, з характерним запахом,
добре розчинні у воді. Температура
плавлення метанолу —![]() ,
етанолу —
,
етанолу —![]() .
Температура кипіння метанолу —
.
Температура кипіння метанолу —![]() ,
етанолу —
,
етанолу —![]() .
.
Біологічна дія спиртів.
Метанол — дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту, у великих (30 мл) — смерть.
Етанол — наркотична речовина, у невеликих дозах викликає сп’яніння, у великих — смерть. При постійному вживанні етанолу розвивається захворювання — алкоголізм.
Добування спиртів.
Приєднання води до алкенів (гідратація):
![]()
![]()
або
Із галогенопохідних:
![]()
![]()
Каталітичний синтез метанолу з карбон(ІІ) оксиду і Гідрогену за температури близько
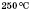 , тиску 7 МПа, каталізатор — суміш цинк
оксиду і купрум(II) оксиду:
, тиску 7 МПа, каталізатор — суміш цинк
оксиду і купрум(II) оксиду:
![]()
Етанол утворюється в результаті бродіння глюкози:
![]()
Хімічні властивості спиртів (на прикладі етанолу).
Горіння:
![]()
Утворюються вуглекислий газ і вода (при достатній кількості кисню). Реакція проходить із великим виділенням теплоти.
Взаємодія з активними металами:
![]()
Утворюються водень і алкоголяти (у даному випадку — калій етилат).
Взаємодія з галогеноводнями:
![]()
Внутрішньомолекулярна дегідратація (за температури, що перевищує
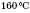 у присутності концентрованої сульфатної
кислоти):
у присутності концентрованої сульфатної
кислоти):
![]()
Міжмолекулярна дегідратація (при надлишку спирту і температурі, що не перевищує :
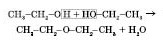
діетиловий естер
Діетиловий естер належить до простих естерів із загальною формулою, діетиловий естер
Діетиловий
естер належить до простих естерів із
загальною формулою,
![]() , де
, де![]() і
і![]() — вуглеводневі радикали спиртів.
— вуглеводневі радикали спиртів.
Застосування спиртів.
Етанол застосовують для добування синтетичного каучуку, пластмас, різних органічних речовин: діетилового естеру, барвників, оцтової кислоти. Його використовують як розчинник для виготовлення парфумів, одеколонів, ліків, лаків і т. д. Етанол у суміші з бензином можна використовувати як пальне для двигунів внутрішнього згоряння.
Метанол застосовують як розчинник або сировину для одержання формальдегіду, деяких барвників, фотореактивів, фармацевтичних препаратів.
Багатоатомні спирти
Багатоатомними називаються спирти, у молекулах яких два або більше атомів Гідрогену заміщені на гідроксигрупи.
Якщо в молекулі спирту містяться три гідроксигрупи, він належить до триатомних спиртів. У назві такого багатоатомного спирту присутній суфікс -тріол.
Загальна
формула триатомних спиртів![]() .
Наприклад, формула пропантріолу-1,2,3
(гліцерину):
.
Наприклад, формула пропантріолу-1,2,3
(гліцерину):
![]()
Феноли
Феноли — це органічні сполуки, у молекулах яких гідроксильні групи зв’язані з бензеновим ядром.
Феноли
з однією гідроксигрупою називаються
одноатомними. Найпростіший фенол має
загальну формулу![]() . Його структурна формула:
. Його структурна формула:
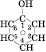 або
або![]()
Радикал
![]() називається феніл.
називається феніл.
У молекулі фенолу відбувається взаємний вплив гідроксигрупи і бензенового ядра, в результаті якого атом Гідрогену гідроксигрупи стає більш реакційноздатним, а фенол виявляє властивості слабкої кислоти (слабкішої за карбонатну). Максимуми електронної густини в бензеновому кільці знаходяться в положеннях Карбону 2, 4, 6 відносно групи -ОН, тому атоми Гідрогену в цих положеннях легше вступають у реакції заміщення.
Фізичні
властивості фенолу. Безбарвна кристалічна
речовина з різким характерним запахом,
частково розчинна у воді (краще
розчиняється в гарячій воді). Температура
плавлення![]() , кипіння
, кипіння
![]() .
Під час зберігання поступово набуває
рожевого забарвлення (окиснюється
киснем повітря). Розчин фенолу у воді
називається ще карболовою кислотою.
.
Під час зберігання поступово набуває
рожевого забарвлення (окиснюється
киснем повітря). Розчин фенолу у воді
називається ще карболовою кислотою.
Біологічна дія фенолу. Отруйний, має сильні антисептичні властивості. У разі попадання на шкіру викликає хімічні опіки.
Добування фенолу.
Із галогенопохідних:
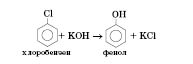
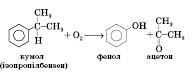
Кумольний метод (окиснення ізопропілбензену киснем повітря) — основний промисловий метод добування фенолу:
Із кам’яновугільної смоли, яка утворюється внаслідок сухої перегонки вугілля.
Альдегіди
Альдегідами
називаються органічні сполуки, у
молекулах яких міститься альдегідна
функціональна група: –![]()
Назви альдегідів за міжнародною номенклатурою утворюються від назв відповідних вуглеводнів із додаванням суфікса -аль. Тривіальні назви утворюються від назв кислот, які можуть бути одержані з цих альдегідів.
Загальна формула альдегідів:
![]()
Ізомерія альдегідів зумовлена зміною в будові карбонового скелета, сполученого з альдегідною групою. Карбон, що входить до альдегідної групи, вважається першим. Наприклад:
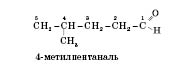
Представники гомологічного ряду альдегідів

Формальдегід
— безбарвний газ із різким задушливим
запахом. Добре розчиняється у воді.
Температура кипіння![]() . Водний 40%-й розчин формальдегіду
називається формаліном.
. Водний 40%-й розчин формальдегіду
називається формаліном.
Ацетальдегід
— безбарвна легколетка рідина з різким
запахом, добре розчинна у воді. Температура
кипіння
![]() .
.
Біологічна дія альдегідів.
Альдегіди — отруйні речовини.
Добування альдегідів.
Окиснення спиртів із гідроксигрупою біля першого атома Карбону:
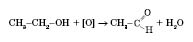
Окиснення алкенів:
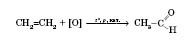
Метаналь добувається каталітичним окисненням метану (каталізатори — нітроген оксиди):
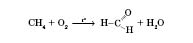
Реакція Кучерова:
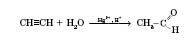
Застосування альдегідів.
Формальдегід застосовують для виробництва фенолформальдегідних смол, барвників, синтетичного каучуку, лікарських і вибухових речовин, а також для дезінфекції приміщень і зберігання біологічних препаратів.
Ацетальдегід застосовують для виробництва оцтової кислоти, а також у деяких органічних синтезах.
ІІ) Карбонові кислоти
Карбонові кислоти — це органічні сполуки, до складу молекул яких входить карбоксильна функціональна група:
–![]()
Насичені одноосновні карбонові кислоти містять одну карбоксильну групу й ординарні карбон-карбонові зв’язки.
У результаті взаємного впливу атомів у карбоксильній групі:
— зв’язок С=О міцніший, ніж в альдегідній групі;
— зв’язок O–H менш міцний, ніж у спиртах;
— атом Гідрогену більш рухливий і реакційноздатний.
Міжнародні систематичні назви карбонових кислот утворюються від назв відповідних вуглеводнів із додаванням закінчення -ова і слова кислота. Наприклад, метанова кислота.
Загальна формула насичених одноосновних карбонових кислот
![]() або
або![]()
Представники гомологічного ряду насичених одноосновних карбонових кислот
Формула |
Назва за міжнародною систематичною номенклатурою |
Тривіальна назва |
НСООН |
Метанова кислота |
Мурашина кислота |
|
Етанова кислота |
Оцтова кислота |
|
Пропанова кислота |
Пропіонова кислота |
|
Бутанова кислота |
Масляна кислота |
|
Пентанова кислота |
Валеріанова кислота |
Ізомерія карбонових кислот зумовлена зміною будови карбонового скелета. Ізомери утворюються у кислот з більш ніж чотирма атомами Карбону, починаючи з бутанової кислоти. Нумерація атомів Карбону починається з Карбону, що входить до складу карбоксильної групи. Наприклад:

Добування карбонових кислот.
Загальний спосіб добування карбонових кислот — окиснення альдегідів або спиртів із гідроксигрупою біля першого атома Карбону:
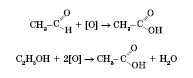
Застосування карбонових кислот.
Мурашина кислота застосовується як протрава для фарбування шерсті, консервант фруктових соків і силосу, використовується для дезінфекції місткостей у харчовій промисловості, у хімічних синтезах.
Оцтова кислота застосовується для добування пластмас, барвників, ліків, штучних волокон, кіноплівки в хімічних синтезах. Вона використовується як приправа до їжі, для консервації овочів. Солі оцтової кислоти використовують для фарбування тканин, а також для боротьби зі шкідниками сільського господарства.
ІІІ) Естери. Жири. Вуглеводи
Естери
Естери можна розглядати як похідні кислот, у яких Гідроген гідроксильної групи заміщений на вуглеводневий радикал спирту.
Назви естерів утворюються від назв відповідних кислот і спиртів з додаванням слова естер. Наприклад, естер
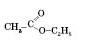
можна назвати етиловий естер оцтової кислоти, за міжнародною систематичною номенклатурою — етилацетат (суфікс -ат).
Загальна формула естерів:
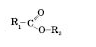
де R1 — вуглеводневий радикал кислоти (у мурашиній кислоті це атом Гідрогену), R2 — вуглеводневий радикал спирту.
Фізичні властивості естерів. Естери нижчих карбонових кислот і спиртів — леткі рідини, малорозчинні або нерозчинні у воді, добре розчинні у спирті та інших органічних розчинниках. Багато естерів мають приємний запах.
Естери вищих кислот і спиртів — воскоподібні речовини, без запаху, нерозчинні у воді, добре розчинні в органічних розчинниках.
Реакція утворення естеру з карбонової кислоти і спирту називається реакцією естерифікації. Наприклад:
CH3–![]() + CH3OH ? CH3–
+ CH3OH ? CH3–
![]() ++
H2O
++
H2O
метилацетат
Хімічні властивості естерів. Взаємодія естеру з водою, що призводить до утворення вихідних спирту і кислоти, називається реакцією гідролізу, або омилення.
Кислотний гідроліз (каталізатор — іони Гідрогену) оборотних:
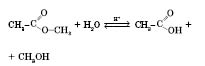
Лужний гідроліз (каталізатор — іони гідроксигрупи) необоротний, оскільки утворюється сіль карбонової кислоти:
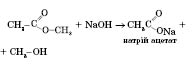
Застосування естерів. Складні естери застосовуються як розчинники та розріджувачі для лаків і фарб, як ароматизатори в харчовій промисловості.
Жири
Жири — це естери, утворені вищими одноосновними карбоновими кислотами й триатомним спиртом гліцерином. Загальна назва таких сполук — тригліцериди. Природні жири — суміш різних тригліцеридів.
Загальна формула тригліцеридів:

де
,
,
![]() — вуглеводневі радикали кислот.
— вуглеводневі радикали кислот.
Назви жирів визначаються назвами кислот, які входять до їхнього складу. Наприклад, жир

називається тригліцерид стеаринової кислоти,або тристеарин.
Фізичні властивості жирів. За кімнатної температури жири бувають рідкими й твердими. Агрегатний стан жирів визначається жирними кислотами, які входять до їхнього складу. Тверді жири утворені насиченими кислотами, рідкі жири (олії) — ненасиченими. Температура плавлення жиру тим вища, чим більше в ньому насичених кислот і чим довший кислотний радикал. Тваринні жири частіше тверді, рослинні частіше рідкі.
Жири розчинні в органічних розчинниках і нерозчинні у воді.
Біологічне значення жирів. Жири входять до складу клітин рослинних і тваринних організмів, є джерелом енергії в клітині, будівельним матеріалом, беруть участь в обміні речовин, відкладаються в тканинах організму як запасна поживна речовина.
Добування жирів. Реакція утворення жиру, наприклад тригліцериду стеаринової кислоти (тристеарину):