
- •1)Дати загальну характеристику неметалічніх елементів. Пояснити явище алотропії а конкретних прикладах. Розкрити хімічні властивості неметалів.
- •2)Оксиди неметалів, їх хімічний характер і властивості.
- •3)Сполуки неметалів з гідрогеном. Амоніак, його властивості і застосування.
- •4)Сульфатна кислота, її властивості , якісна реакція на сульфат-йон.
- •5)Нітратна кислота, нітрати, вплив нітратів на живі організми.
- •6)Ортофосфатна кислота, поняття про мінеральні добрива.
- •7)Особливості карбонатної кислоти, значення карбонатів, твердість води і методи її усунення.
- •8)Загальна характеристика металів,їх поширення в природі, практичне застосування. Поняття про корозію.
- •Понятие о коррозии металлов
- •9)Металічний зв’язок , фізичні і хімічні властивості металів.
- •10)Лужні і лужноземельні метали, їх біологічна роль, практичне застосування.
- •11)Алюміній як амфотерний метал, властивості його оксиду і гідроксиду, практичне застосування алюмінію.
- •12)Ферум як метал побічних підгруп, його будова, властивості, застосування.
- •13)Роль металів і сплавів в сучасній техниці.
- •14)Теорія будови органічних сполук о.М.Бутлерова, явище ізомерії.
- •15)Причини багатоманітності і різноманітності органічних сполук.
- •16)Вуглеводні: алкани, алкени алкіни, дієни, Їх будова, номенклатура, властивості, застосування.
- •Гомологи метану
- •17)Природні джерела вуглеводнів: нафта, природний газ. Способи переробки нафти.
- •18)Оксигеновмісні органічні сполуки: спирти, альдегіди , карбонові кислоти, естери. Їх хімічна будова, функціональна група, номенклатура, властивості, застосування.
- •19)Жири як естери, їх склад, фізичні і хімічні властивості, біологічне значення, практичне застосування.
- •20)Вуглеводи: їх склад, будова, біологічні функції, застосування.
- •21)Нітрогеновмісні органічні сполуки: аміни, амінокислоти. Здатність амінокислот утворювати поліпептиди.
- •22)Білки: їх склад, просторова будова, фізичні властивості, біологічні функції, практичне застосування.
- •23)Методи якісного визначення білків.
- •24)Полімерні матеріали, пластмаси. Полімерні матеріали
- •25)Хімія і їжа, вітаміни, харчові добавки.
- •26)Роль хімії в медицині.
- •27)Хімія та побут: побутові хімікати.
14)Теорія будови органічних сполук о.М.Бутлерова, явище ізомерії.
Створення теорії хімічної будови органічних сполук О. М. Бутлеровим у 60-х роках XIX ст. було найвидатнішою подією в історії розвитку органічної хімії. Ця теорія стала науковою основою для подальшого розвитку органічної хімії. О. М. Бутлеров виходив із матеріалістичних уявлень про реальне існування атомів і молекул. Основна ідея теорії хімічної будови органічних сполук була сформульована О. М. Бутлеровим у 1861 р. Суть цієї теорії полягає в слідуючому: 1. Атоми в молекулах органічних речовин сполучені між собою в певному порядку. Послідовність сполучення атомів у молекулі О. М. Бутлеров назвав хімічною будовою, або структурою, молекули. 2. Властивості молекул органічних речовин залежать від природи атомів, що входять до складу молекул, від кількості цих атомів і від порядку їх сполучення в молекулі, тобто від хімічної будови молекули. 3. Органічні речовини з однаковим якісним і кількісним складом, але з різною хімічною будовою - ізомери - мають різні хімічні властивості. 4. Знаючи властивості органічних речовин, можна встановити їх хімічну будову. 5. Реакційна здатність (хімічна активність) атомів, що входять до складу молекули органічної речовини, може змінюватись залежно від того, з якими іншими атомами вони зв'язані в даній молекулі. Ця зміна хімічної активності атомів обумовлюється взаємним впливом безпосередньо сполучених (сусідніх) атомів, а також взаємним впливом атомів через інші атоми (посередній вплив). З виникненням теорії хімічної будови органічна хімія вийшла із лабіринту типових формул. Завдяки цій теорії були знайдені шляхи до пізнання внутрішньої будови молекул, з'явилась теоретична основа для розуміння хімічних процесів. Теорія хімічної будови дозволила класифікувати не тільки весь нагромаджений на той час, але й новий експериментальний матеріал. Хіміки, користуючись цією теорією, могли передбачити як нові шляхи синтезу органічних речовин, так і можливу кількість органічних сполук певного складу. З моменту свого виникнення теорія хімічної будови дала можливість хімікам проводити експериментальні дослідження цілеспрямовано, експериментальне перевіряти і встановлювати будову молекул органічних речовин. Великим успіхом теорії хімічної будови було обгрунтування явища ізомерії, яке протягом майже сорока років не знаходило теоретичного пояснення. Так, наприклад, дві різні речовини етанол і диметиловий ефір мають одну і ту саму молекулярну формулу С2Н6О : Н3С - СН2 - ОН Н3С - O - СН3 Етанол Диметиловий ефір Але оскільки ці речовини мають різну хімічну будову, це зумовлює їх різні властивості. Так, етанол добре розчиняється у воді, за звичайних умов реагує з металічним натрієм, в той час як диметиловий ефір не розчиняється у воді і не взаємодіє з металічним натрієм. Теорію хімічної будови О. М. Бутлеров та його учні, а потім і інші хіміки підтвердили, синтезувавши всі передбачені ізомери найпростіших органічних речовин. Так, було синтезовано ізобутан, ізобутилен, третинні спирти тощо. Теорія хімічної будови органічних сполук набула дальшого розвитку завдяки дослідженням учнів О. М. Бутлерова - В. В. Марков-никова, А. М. Зайцева, Є. Є. Вагнера, які глибоко вивчили взаємний вплив атомів у молекулах органічних речовин, розробили нові методи синтезу різних класів органічних сполук. Ця теорія стала загальною теорією органічної хімії. Створення теорії хімічної будови сприяло бурхливому розвитку органічної хімії. Вже наприкінці XIX ст. методи синтезу органічних сполук почали проникати в хімічну промисловість. Виникли виробництва синтетичних барвників, вибухових речовин, медикаментів. Сировину для них постачає коксохімічна промисловість. Необхідні для цих виробництв органічні сполуки добувають в основному з кам'яновугільної смоли і продуктів її переробки. Розвиток промисловості, в свою чергу, стимулював наукові дослідження. Великий внесок у дальший розвиток органічної хімії зробили радянські вчені О. Є. Фаворський, М. Д. Зелінський, С. В. Лебедєв, О. М. Несмєянов, І. Н. Назаров, Б. А. Казанський, К. А. Андріанов, М. І. Кабачник, Л. І. Кнунянц, О. Є. Порай-Кошиць, М. М. Ворожцов, О. Є. Арбузов, М. М. Семенов, М. М. Шемякін та ін. Завдяки дослідженням радянських хіміків Радянський Союз за виробництвом хімічної продукції зайняв перше місце в Європі і друге в світі (після США), а за темпами розвитку хімічної промисловості випередив всі капіталістичні країни, 3 року в рік значно зростає випуск, розширюється асортимент синтетичних смол, каучуків, хімічних волокон, барвників, медикаментів, засобів захисту рослин і т. д. Сучасний період розвитку органічної хімії характеризується великими успіхами в синтезі природних біологічно активних речовин: хлорофілу, гормонів, вітамінів, антибіотиків, алкалоїдів. Успішно вирішується проблема біосинтезу білка. Так, протягом останніх років розшифровано будову молекул деяких білків, синтезовано найпростіші білкові речовини, вивчено роль нуклеїнових кислот у синтезі білка, збереженні і передачі спадкової інформації, синтезовано ген. Перш ніж приступити до вивчення будови органічної речовини, її слід очистити. Для очищення твердих органічних речовин найчастіше використовують методи кристалізації і сублімації. Рідкі речовини очищають методом перегонки. Ступінь чистоти органічних речовин встановлюють, як правило, за фізичними константами, найчастіше за температурами плавлення і кипіння, а для рідких речовин, крім того, визначають ще густину і показник заломлення. Визначати ступінь чистоти органічних речовин можна також хроматографічним або спектральним методом. Органічні речовини, що використовуються як фармацевтичні препарати, повинні бути абсолютно чистими. Для встановлення будови органічної речовини насамперед слід визначити її якісний та кількісний склад, загальну формулу та молекулярну масу. Після цього різними хімічними і фізичними методами визначають, які фрагменти, функціональні групи і зв'язки є в даній речовині і на основі одержаних результатів роблять висновок про її будову. Одним з надзвичайно важливих методів встановлення будови органічних речовин є спектральний аналіз, оскільки кожна речовина має властивий їй спектр поглинання. Найчастіше використовують спектроскопію у видимій, ультрафіолетовій та інфрачервоній областях спектра ядерний магнітний резонанс, мас-спектрометрію. Особливо велику інформацію про будову органічних речовин дають інфрачервоні спектри (ІЧ-спектри), оскільки кожна група атомів поглинає інфрачервоне світло тільки з певною довжиною хвилі. Це дозволяє на основі аналізу 14-спектра зробити висновок про будову вуглецевого скелета органічної молекули та наявність у ній функціональних груп.
Ізомерія – явище, при якому різні сполуки, що мають однаковий якісний і кількісний склад, відрізняються своїми властивостями. Ізомерія пояснюється різною будовою молекул таких сполук (ізомерів). Відомо два основні типи ізомерії: структурна і просторова (стереоізомерія). Молекули структурних ізомерів різняться порядком зв’язку атомів і молекул, тобто хімічною будовою. В молекулах стереоізомерів хімічна будова однакова, але атоми по-різному розміщені в просторі. В гомологічному ряду вуглеводнів структурна ізомерія можлива з C4H10 : н-бутан CH3CH2CH2CH3 та ізобутан (CH3)2СН-СН3. Із збільшенням кількості атомів карбону число ізомерів швидко зростає. В ряду ароматичних вуглеводнів існує ізомерія положення відносно замісника та ізомерія в бензольному кільці:

Ізомери можуть відрізнятися не тільки будовою карбонового ланцюга, а й характером функціональних груп: наприклад, ізомерами є етиловий спирт CH3CH2OH і дим етиловий етер CH3 – O – CH3. До просторової ізомерії відносять геометричну (цис – транс - ізомерія) і оптичну ізомерію. Просторова ізомерія можлива для сполук, що містять подвійні зв’язки. Приклад геометричних ізомерів:

Оптична ізомерія виникає при наявності просторової асиметрії молекул, найчастіше завдяки асиметричним атомам карбону, наприклад молочна кислота CH3 – C*H(OH) – COOH(асиметричний атом позначено *). Ізомерія є однією з причин, що зумовлює величезну кількість органічних сполук.
Номенклатура алканів Насичені вуглеводні, молекули яких мають відкритий карбоновий ланцюг, називають алканами. У ХХ ст. було запропоновано систему назв(систематичну номенклатуру) органічних сполук. Згідно з нею, назви усіх алканів мають суфікс –ан. Для перших чотирьох сполук гомологічного ряду використовують такі назви:
CH4 – метан;
С2Н6 – етан;
С3Н8 – пропан;
С4Н10 – бутан.
Основу решти алканів становлять грецькі числівники, які відповідають кількості атомів Карбону в молекулах сполук. Приклади: С5Н12 – пентан, С6Н14 – гексан, С7Н16 – гептан, С8Н18 – октан, С9Н20 – нонан, С10Н22 – декан (5 – «пента», 6 – «гекса» і т.д.). Якщо молекула вуглеводню має лінійну будову, то перед назвою алкану додають літеру н (тобто, «нормальна будова»). Наприклад, сполуку із формулою CH3 - CH2 - CH2 - CH3 називають н – бутаном. Другий ізомер бутану має назву «ізобутан». Якщо для вуглеводню існує кілька ізомерів, то їх назви повинні відрізнятися. Для цього у правилах складання назв використовують поняття замісник. Замісник – це атом або група атомів, яка є відгалуженням від лінійного або замкненого карбонового ланцюга молекули. Замісники часто позначають літерою R. Якщо замісник складається з атомів Карбону і Гідрогену, то його називають вуглеводневим залишком. Формулу вуглеводневого залишку можна отримати, віднявши від формули алкану атом Гідрогену. Назва такого замісника походить від назви алкану і має суфікс -ил(-іл):
CH3 – метил;
С2Н5 – етил;
С3Н7 – пропіл;
С4Н9 – бутил.
Ці замісники мають загальну назву алкіли. Їх загальна формула – СnH2n+1. Замісником у молекулі ізобутану
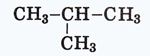
є група атомів СН3 , а молекула
![]()
містить три замісники – групу атомів С2Н5 і дві групи СН3.
Правила складання назв алканів:
1. У молекулі знаходять найдовший (головний) карбоновий ланцюг і нумерують у ньому атоми Карбону. Нумерацію починають із того кінця ланцюга, до якого ближче знаходиться замісник.
2. Визначають назву кожного замісника.
3. Назви замісників розміщують на початку назви сполуки (за алфавітом). Перед назвою кожного замісника через дефіс указують номер атома карбону, з яким сполучений замісник. Останньою записують назву алкану нерозгалуженої будови, молекула якого містить стільки атомів Карбону, скільки їх у головному ланцюзі.
4. При наявності кількох однакових замісників їх кількість указують, добавляючи до назви замісника числовий префікс (ди-, три-, тетра- тощо), а перед ним указують номери відповідних атомів Карбону, розділені комами.
