
- •1.1. Эпидемиология
- •1.2. Этиология, патогенез и факторы риска
- •1.8. Классификация рака шейки матки
- •1.9. Лечение рака шейки матки
- •2.1. Эпидемиология
- •IV. Изменения диффузной эндокринной системы (apud)
- •2.8. Лечение рака эндометрия
- •3.1. Эпидемиология
- •3.8. Классификация рака яичников
- •3.9. Лечение рака яичников
IV. Изменения диффузной эндокринной системы (apud)
Повышенное содержание апудоцитов выявлено при раке эндометрия в 19-26% наблюдений. Эти эндокринные клетки вырабатывают биогенные амины и пептидные гормоны серотонин, норадреналин, мелатонин. Гиперплазия апудоцитов эндометрия способствует развитию эндокринно-обменного паранеопластического синдрома, присущего первому патогенетическому варианту рака эндометрия и влияет на клиническое лечение опухоли, ингибируя процессы деления клеток. Нормальный эндометрий содержит апудоциты в небольшом количестве. В атрофичном эндометрии они отсутствуют, что связано с низким уровнем происходящих в нем обменных процессов. Частота обнаружения апудоцитов в эндометрии при железистой гиперплазии эндометрия (ЖГЭ) составляет 18,3%, при атипической гиперплазии эндометрия (АГЭ) 25%.
Серотонин и норадреналин, синтезируемые в эндокринных клетках рака эндометрия, обладают антипролиферативной активностью. Это может служить косвенным объяснением более благоприятного клинического течения при первом патогенетическом варианте РЭ. Вместе с тем обнаружение высокого содержания апудоцитов у больных ЖГЭ и АГЭ указывает на высокий риск малигнизации.
Предраковая патология. Традиционно в качестве фоновой и предраковой патологии при изучении злокачественных опухолей матки рассматривают гиперпластические процессы эндометрия, выделяя три основные формы – железистая гиперплазия, эндометриальные полипы и атипическая гиперплазия эндометрия. Далее мы приведём классификацию, дающую наиболее точные представления об этой патологии.
Гистологическая классификация опухолей женского полового тракта (1994 год).
I. Типичная гиперплазия эндометрия:
1) простая гиперплазия без атипии (рис. 25);
2) сложная гиперплазия без атипии (аденоматоз без атипии).
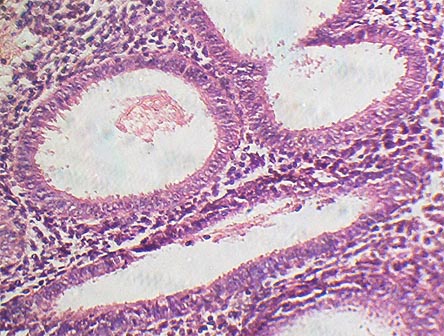
Рис. 25. Железисто-кистозная гиперплазия эндометрия. Соответствует типичной простой гиперплазии по приведённой классификации.
II. Атипичная гиперплазия эндометрия:
1) простая атипичная гиперплазия;
2) сложная атипичная гиперплазия (аденоматоз с атипией).
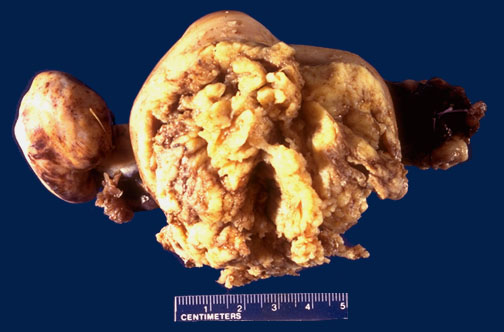
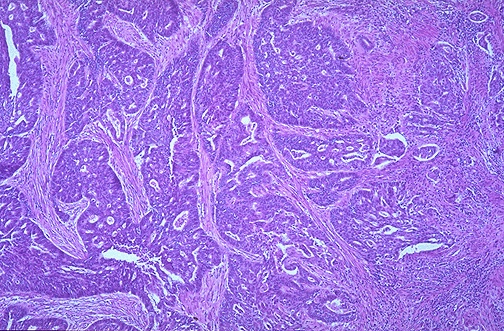
Рис. 26. Аденокарцинома эндометрия. а прорастание стенки матки до серозной оболочки; б гистологическое строение, ув. х.100.
Железистая гиперплазия эндометрия (ЖГЭ) часто определяется у больных с ановуляторными маточными кровотечениями. Железистая и железисто-кистозная гиперплазия по существу равнозначные процессы. Различие между ними состоит в наличии кистознорасширенных желез при железисто-кистозной форме гиперплазии и отсутствии кист при железистой гиперплазии. Поэтому считают, что принципиальной разницы между указанными видами гиперплазии не существует. Такая патология соответствует типичной гиперплазии эндометрия (согласно гистологической классификации 1994 года).
Полипы эндометрия развиваются вследствие пролиферации желез базального слоя эндометрия. Полипы имеют ножку, состоящую из фиброзной и гладкомышечной ткани, чаще располагаются в области дна и трубных углов матки. Различают следующие формы полипов эндометрия: железистые, железисто-фиброзные и фиброзные. Если в железах полипа находят атипию эпителия, следует ставить диагноз не «аденоматозного полипа», а «атипической гиперплазии в полипе». Малигнизация эндометриальных полипов составляет 2-5%, но в постменопаузе частота малигнизации достигает 10%.
Атипическая гиперплазия эндометрия (АГЭ) может развиваться как в утолщенном (гиперплазированном), так и в истонченном (атрофическом) эндометрии и в полипах. АГЭ может быть локальной и диффузной.
Выделяют 3 формы АГЭ: слабую, умеренную, тяжелую. Дискуссионным остается вопрос о правомерности диагноза «carcinoma in situ» эндометрия. С точки зрения онкологов тяжелая АГЭ эквивалентна современным представлениям о преинвазивном раке. Но гистологический диагноз «carcinoma in situ» при исследовании соскобов проблематичен, так как тяжелую АГЭ трудно дифференцировать от высокодифференцированной аденокарциномы. Hertig (1984) наблюдал развитие рака в 26,7% случаев при слабой и в 81,8% при умеренной АГЭ. Во всех случаях тяжелой формы АГЭ, которую он обозначал как «carcinoma in situ», отмечена прогрессия в инвазивный рак. Сводные данные литературы дают следующие показатели: прогрессия АГЭ в инвазивный рак (рис.26) отмечается в 20-50% наблюдений (в среднем 40%) на протяжении от 1 года до 13 лет, что определяет необходимость ее выявления и безотлагательного лечения.
Хотелось бы остановиться на встречающихся терминах - атипическая гиперплазия и аденоматозная гиперплазия эндометрия. С точки зрения приведённой классификации, это два разных патологических процесса. Аденоматозной может являться и типичная гиперплазия. Однако в Международной классификации болезней десятого пересмотра, для этой патологии приводится лишь одна нозологическая форма – «N 85,1» и соответствующая ей запись – «атипическая (аденоматозная) гиперплазия». То есть, по мнению авторов, клинически нет разницы между атипией и аденоматозом. Чтобы не входить в противоречие с гистологической классификацией, мы предлагаем при формулировке диагноза использовать только термин «атипическая гиперплазия эндометрия» и не обозначать диагноз как «аденоматозная гиперплазия».
2.3. Клинические проявления рака эндометрия
Жалобы больных при раке эндометрия условно делят на 3 группы:
1) связанные с нарушением менструальной функции (кровянистые выделения в пременопаузе, постменопаузе);
2) обусловленные болевым синдромом;
3) вызванные обменными и эндокринными нарушениями.
Кровянистые выделения из половых путей различного характера самая частая и, что очень важно, ранняя жалоба, предъявляемая больными злокачественными опухолями тела матки. Матка достаточно стереотипно реагирует на патологический процесс слизистой оболочки. Различия в характере кровянистых выделений зависят в основном от возраста больных.
В репродуктивном возрасте – кровянистые выделения из половых путей в межменструальный период, а также до или после менструации.
В пременопаузальном периоде – нерегулярные, обильные менструации с последующей длительной кровянистой «мазнёй» или кровотечениями.
В постменопаузе – больные отмечают скудные кратковременные или длительные кровянистые выделения, контактные кровотечения.
2.4. Группы риска больных по развитию рака эндометрия
Группы риска связаны:
1) с поздним наступлением менопаузы;
2) с ожирением, сахарным диабетом, гипертонической болезнью;
3) с рецидивирующими дисфункциональными маточными кровотечениями и гиперэстрогенией в постменопаузе;
4) с ановуляторными циклами;
5) с диэнцефальным синдромом, протекающим по типу болезни Иценко-Кушинга;
6) с феминизирующими опухолями яичников;
7) с гиперпластическими процессами эндометрия, особенно рецидивирующими и протекающими на фоне ожирения, артериальной гипертензии, нарушением синтеза белка в печени, функции щитовидной железы;
8) с синдромом Штейна-Левенталя.
2.5. Диагностика
Используется целый комплекс методов определения состояния слизистой оболочки тела матки.
Эхография органов малого таза. У здоровых женщин репродуктивного возраста длина матки в среднем равна 5,38+0,03 см, ее переднезадний размер 4,23±0,02 см, ширина 5,11±0,07 см. Значения М-эха составляют: длина 2,48±0,04 см, переднезадний размер 0,49±0,01 см, ширина 1,9±0,03 см.
В пременопаузальном периоде с учетом величины М-эхо пациентки подразделяются на 3 группы:
1) М-эхо в пределах нормальной величины, наиболее частой причиной кровотечения является миома матки и внутренний эндометриоз;
2) величина М-эхо в пределах 9-14 мм, наиболее частой причиной кровотечения является гиперплазия эндометрия;
3) величина срединных маточных структур превышает 14 мм, причиной атипических кровотечений являются гиперпластические процессы эндометрия. Однако именно в этой группе наиболее часто диагностируется злокачественный процесс.
В постменопаузальном периоде с учетом величины М-эхо пациентки подразделяются на 2 группы:
1) величина М-эхо в пределах возрастной нормы (до 4мм.), патология диагностируется чаще всего в цервикальном канале или происходит на фоне атрофии эндометрия.
2) величина срединных маточных структур превышает 4 мм, наиболее частой патологией являются различные гиперпластические процессы и рак эндометрия.
Аспирационно-цитологическое исследование эндометрия. Цитологическое исследование аспирата из полости матки позволяет оценить выраженность пролиферативных изменений эндометрия, но не дает представления о патоморфологической структуре. Этот метод следует рекомендовать как скрининг в процессе оценки эффективности гормонального лечения. Аспират из полости матки необходимо исследовать каждой больной, входящей в группу риска по ГПЭ. Но этот метод нельзя рассматривать в качестве альтернативы раздельному диагностическому выскабливанию полости матки.
Гистероскопия с прицельной биопсией. Диагностическая эффективность данного метода 86-96%, позволяет более детально изучить состояние эндометрия, а также провести топическую диагностику и сделать прицельным раздельное выскабливание полости матки. Ценность гистероскопии состоит также в том, что она позволяет оценить корригирующую терапию, а также проводить диагностику сопутствующей внутриматочной патологии, например подслизистую миому матки, которая сопровождается кровотечениями, и эндометриоз матки.
Гистологическое исследование соскоба эндометрия. Это основной способ диагностики. Раздельное диагностическое выскабливание слизистой оболочки матки и цервикального канала позволяет получить материал для исследования из всех участков матки. Зондирование полости матки и расширение цервикального канала, выполняемое до взятия материала из эндоцервикса, могут исказить картину за счёт попадания частиц из полости матки в цервикальный канал. Возможно, более точно судить о характере изменений в цервикальном канале можно, если выполнить забор тканей эндоцервикса до прохождения зондом внутреннего зева. Пользоваться частичным соскобом (цугом, штрих-биопсией) при ГПЭ не рекомендуется.
При сохраненном ритме менструаций выскабливание целесообразно проводить в секреторной фазе, за 3-4 дня до ожидаемой менструации. При очаговой гиперплазии и полипах эндометрия на 5-7 день менструального цикла. При метроррагии в 1 день появления кровянистых выделений.
Гистеросапьпингография. Диагностическая эффективность 54-86%. При проведении гистеросапьпингографии лучше использовать водорастворимые контрастные вещества (верографин, урографин, уротраст, триомбрин) в виде 60-70% раствора. Целесообразно проводить в 1 фазу менструального цикла (5-7 день), что позволяет выявить не только изменения эндометрия, но и нередко сопутствующий внутренний эндометриоз. Однако ценность данного исследования значительно снизилась после появления в арсенале гинекологов эндоскопического метода визуализации – гистероскопии.
2.6. Диагностический алгоритм
При подозрении на злокачественный процесс тела матки последовательно проводят:
1) общеклиническое исследование;
2) бимануальное и ректовагинальное исследование;
3) цитологическое исследование аспирата из полости матки;
4) раздельное диагностическое выскабливание цервикального канала и полости матки;
5) гистероскопию или гистерографию;
6) ультразвуковое исследование органов малого таза и органов брюшной полости, забрюшинных лимфоузлов таза и поясничной области, мочевыводящих путей;
7) цистоскопию и ректороманоскопию (при подозрении на распространённый процесс);
8) при необходимости компьютерная томография, экскреторная урография, ирригоскопия, пункция ЛУ, радиоизотопное исследование функции почек.
2.7. Классификация рака эндометрия
Классификация применима для рака и злокачественных смешанных мезодермальных опухолей. Должно быть гистологическое подтверждение диагноза и определена гистопатологическая дифференцировка и grade (G). Диагноз должен основываться на данных исследования материала, полученного при частичном выскабливании.
Для оценки категорий Т, N и М применяются следующие методы.
Т-категории физикальный осмотр и методы визуализации, включая урографию и цистоскопию;
N-категории физикальный осмотр и методы визуализации, включая урографию;
М-категории физикальный осмотр и методы визуализации.
Регионарные лимфатические узлы. Регионарными лимфатическими узлами матки являются тазовые (подчревные, запирательные), общие, внутренние и наружные подвздошные, расположенные около матки, крестцовые (рис. 27).

Рис. 27. Регионарные лимфоузлы. 1 внутренние подвздошные (включая запирательные); 2 общие подвздошные; 3 внешние подвздошные; 4 боковые крестцовые.
Критерий «Т» – является характеристикой первичной опухоли. Для сравнения в таблице наряду с критериями TNM приведены данные классификации Всемирной организации акушеров и гинекологов (FIGО) (табл. 3).
Таблица 3
Классификация TNM и классификация Всемирной организации акушеров и гинекологов (FIGО) рака эндометрия
TNM |
FIGО |
|
Тx |
|
Недостаточно данных для оценки первичной опухоли |
Т0 |
|
Первичная опухоль не определяется |
Tis |
0 |
Преинвазивная карцинома (Carcinoma in situ) |
Tl |
I |
Опухоль ограничена телом матки (рис. 28а) |
Т la |
IA |
Опухоль ограничена эндометрием |
T1b |
IB |
Опухоль распространяется не менее чем на половину миометрия |
T1c |
IС |
Опухоль распространяется больше, чем на половину миометрия |
Т2 |
II |
Опухоль распространяется на шейку, но не за пределы матки (рис. 28б) |
Т2а |
IIA |
Вовлечены только эндоцервикальные железы |
Т2b |
II В |
Инвазия стромы шейки |
Т3 и/или N1 |
III |
Местное и/или регионарное распространение как в ТЗа, b, N1 и FIGO IIIA, В, С (рис. 29) |
Т3а |
IIIA |
Опухоль вовлекает серозную оболочку и/или яичник (прямое распространение или метастазы) и/или раковые клетки в асците или промывных водах |
Т3b |
III В |
Опухоль распространяется на влагалище (прямое или метастазы) |
N1 |
IIIС |
Метастазы в регионарные лимфатические узлы |
Т4 |
IVA |
Опухоль распространяется на слизистую оболочку мочевого пузыря и/или толстой кишки Примечание. Присутствие буллезного отека недостаточно для отнесения опухоли к Т4. |
Ml |
IVB |
Отдаленные метастазы (исключая метастазы во влагалище, серозу таза и яичник, включая метастазы во внутриабдоминальные лимфатические узлы) |
Примечание: FIGО (2001) рекомендует классифицировать опухоли с 1 стадией, получающих лучевую терапию, следующим образом: стадия 1 – опухоль ограничена телом матки; стадия 1А – длина полости матки ≤ 8 см; 1В – длина полости матки > 8 см. Данная рекомендация в настоящее время не используется.
а
 б
б
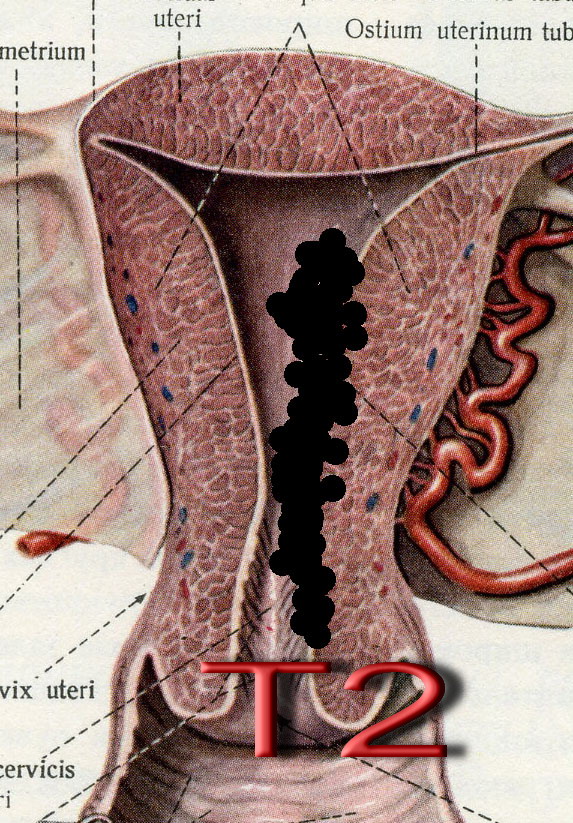
Рис. 28. Стадирование злокачественного новообразования тела матки по символу T. а - опухоль ограничена слизистой оболочкой матки (Т1а), инвазия опухоли в миометрий до половины толщины стенки (Т1b), инвазия опухоли достигает серозного покрова матки (Т1с); б переход опухолевого поражения на цервикальный канал (Т2).
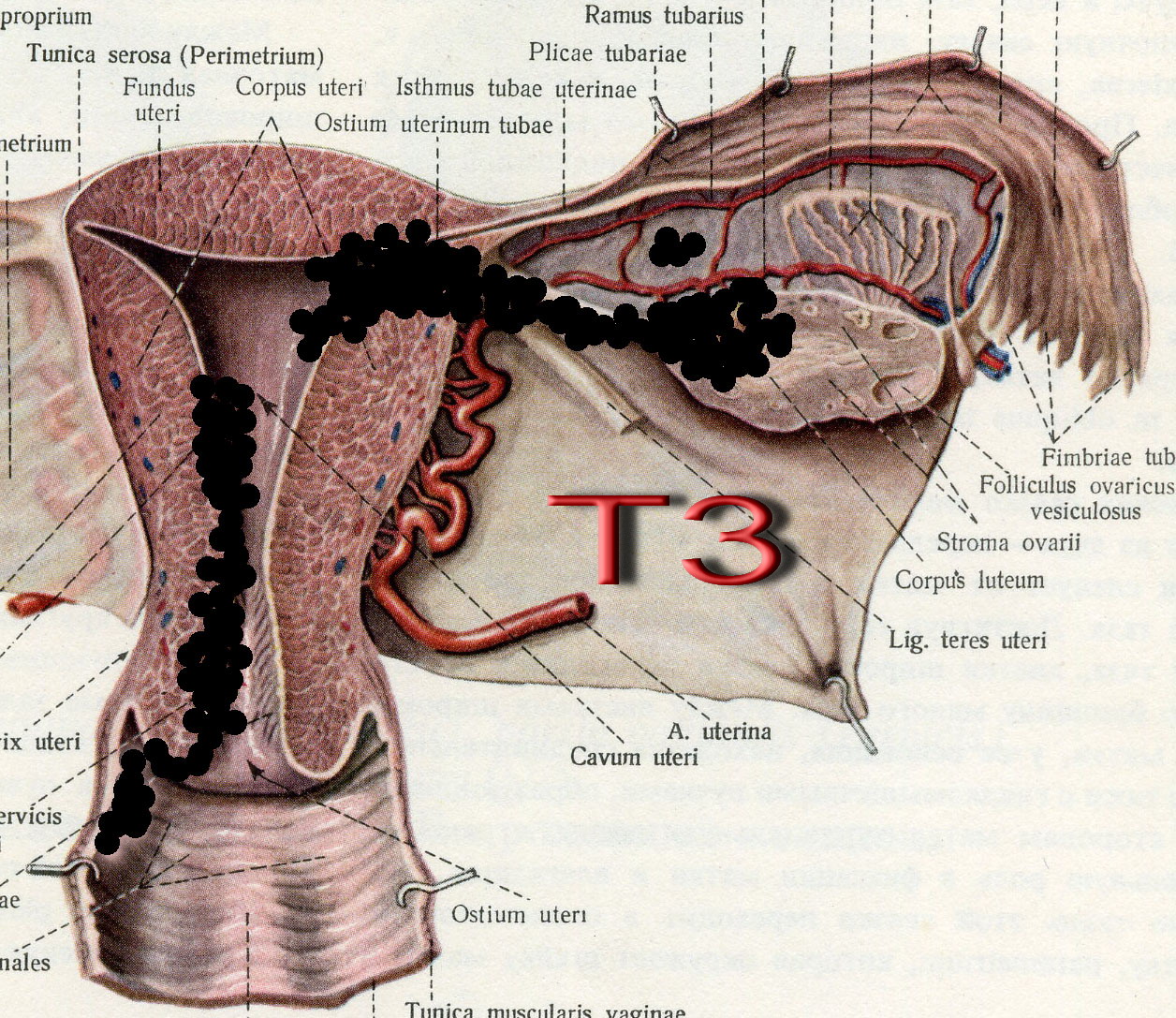
Рис. 29. Стадирование злокачественного новообразования тела матки по символу T. Переход опухоли на стенку влагалища, выход за пределы матки (Т3).
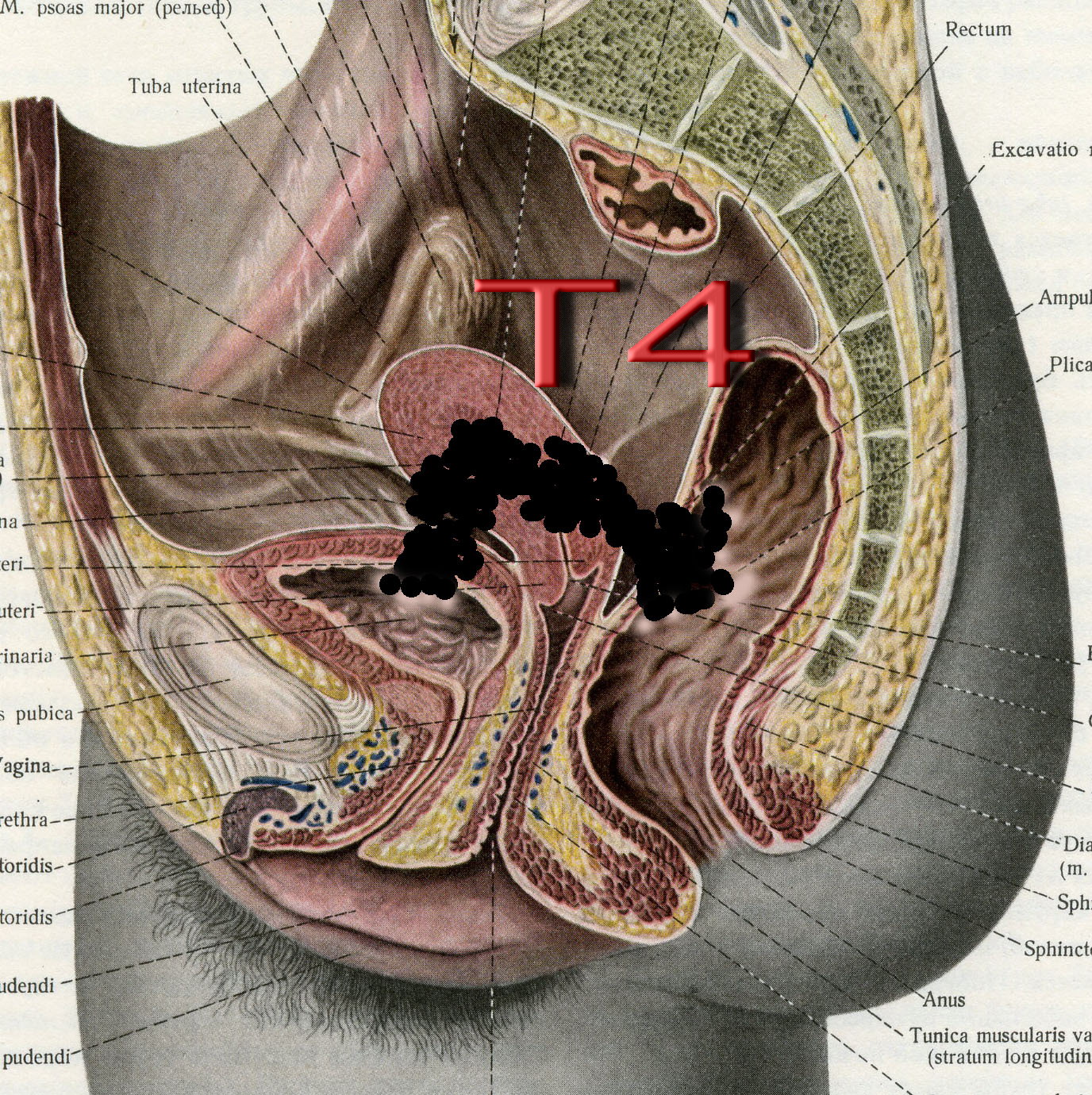
Рис. 30. Стадирование злокачественного новообразования тела матки по символу T. Непосредственное прорастание опухолью слизистой мочевого пузыря и/или прямой кишки. (Т4).
N регионарные лимфатические узлы
Nx недостаточно данных для оценки состояния регионарных лимфатических узлов;
No нет признаков поражения метастазами регионарных лимфатических узлов;
N1 метастазы в регионарных лимфатических узлах;
М отдаленные метастазы
Mх недостаточно данных для определения отдалённых метастазов;
M0 нет признаков отдалённых метастазов;
M1 имеются отдалённые метастазы.
Гистопатологическая дифференцировка (G)
Gх – степень дифференцировки не может быть установлена;
G1 – высокая степень дифференцировки;
G2 – средняя степень дифференцировки;
G3 – низкая степень дифференцировки.
Группировка по стадиям с учетом вышеназванных критериев представлена в таблице 4.
Таблица 4
Группировка рака эндометрия по стадиям развития процесса
Стадия |
Критерии TNM |
||
T |
N |
M |
|
Стадия 0 |
Tis |
N0 |
М0 |
Стадия 1А |
T1a |
N0 |
М0 |
Стадия IB |
T1b |
N0 |
М0 |
Стадия 1С |
T1c |
N0 |
М0 |
Стадия IIA |
T2a |
N0 |
М0 |
Стадия IIB |
T2b |
N0 |
М0 |
Стадия IIIА |
Т3а |
N0 |
М0 |
Стадия IIIВ |
Т3В |
N0 |
М0 |
Стадия IIIС |
Т1 |
N1 |
М0 |
Т2 |
N1 |
М0 |
|
ТЗ |
N1 |
М0 |
|
Стадия IVA |
T4 |
Любая N |
М0 |
Стадия IVB |
Любая Т |
Любая N |
Ml |
