
- •52.Поверхночтные явления и адсорбция
- •53.Поверхностное напряжение и адсорбция по Гиббсу
- •54.Адсорбция на границе твердое тело-газ.
- •58) Оптические свойства дисперсных систем и форма частиц
- •60) Устойчивость и коагуляция дисперсных систем.
- •61) Строение органических веществ. Теория химического строения а.М. Бутлерова
- •63) Взаимное влияние атомов в молекулах органических соединений. Индуктивный и мезомерный эффект.
- •65) Виды изомерии.
- •67) . По числу и составу реагентов и продуктов (слайд 3)
- •83) Альдегидами называются соединения, в которых карбонильная группа
- •86) Химические свойства карбоновых кислот и их производных
- •88) Функциональные производные карбоновых кислот. Двухосновные карбоновые кислоты. ,-Ненасыщенные кислоты
- •92) Вопр.№92
- •94) В настоящее время известно четыре основных метода синтеза высокомолекулярных соединений:
67) . По числу и составу реагентов и продуктов (слайд 3)
а) разложения (слайд 4)
Реакции разложения в органической химии, в отличие от реакций разложения в неорганической химии, имеют свою специфику. Их можно рассматривать как процессы, обратные присоединению, поскольку в результате чаще всего образуются кратные связи или циклы.
б) соединения (слайд 5)
Для того чтобы вступить в реакцию присоединения, органическая молекула должна иметь кратную связь (или цикл), эта молекула будет главной (субстрат). Молекула попроще (часто неорганическое вещество, реагент) присоединяется по месту разрыва кратной связи или раскрытия цикла.
в) замещения (слайд 6)
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
г) обмена (в том числе и нейтрализации) (слайд 7)
Рекомендуется провести в форме лабораторной работы согласно уравнений реакций, предложенных в презентации
2. По тепловому эффекту (слайд 8)
а) эндотермические
б) экзотермические (в том числе и реакции горения)
В презентации предложены реакции из неорганической и органической химии Реакции соединения будут реакциями экзотермическими, а реакции разложения — эндотермическими (относительность этого вывода подчеркнет редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + 02 —> 2NO - Q
3. По использованию катализатора (слайд 9)
а) каталитические (в том числе и ферментативные)
б) некаталитические
4. По направлению (слайд 10)
а) каталитические (в том числе и ферментативные)
б) некаталитические
5. По фазе (слайд 11)
а) гомогенные
б) гетерогенные
6. По изменению степени окисления элементов, образующих реагенты и продукты (слайд 12)
а) окислительно-восстановительные
б) без изменения степени окисления
К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. В более обобщенном варианте (уже с учетом и органической химии): все реакции с участием простых веществ. И наоборот, к реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
Восстановление - реакция, обратная окислению. Под действием восстанавливающего реагента соединение принимает атомы водорода или теряет атомы кислорода:
Радикалы свободные, кинетически независимые частицы, характеризующиеся наличием неспаренных электронов
Электрофилами могут быть как положительно заряженные, и нейтральные частицы, имеющие атом с вакантной орбиталью
Нуклеофилы-Частицы, являющиеся донорами электронов
68) Алканы (предельные углеводороды, парафины) – ациклические насыщенные углеводороды общей формулы СnH2n+2. В соответствии с общей формулой алканы образуют гомологический ряд.
Первые четыре представителя имеют полусистематические названия – метан (CH4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10). Названия последующих членов ряда строятся из корня (греческие числительные) и суффикса -ан: пентан (С5Н12), гексан (С6Н14), гептан (С7Н16) и т. д.
Атомы углерода в алканах находятся в sp3-гибридном состоянии. Оси четырех sp3-орбиталей направлены к вершинам тетраэдра, валентные углы равны 109°28 .
Пространственное строение метана:
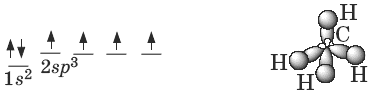
энергия С—С связи Ес—с = 351 кДж/моль, длина С—С связи 0,154 нм.
Связь С—С в алканах является ковалентной неполярной. Связь С—Н – ковалентная слабополярная.
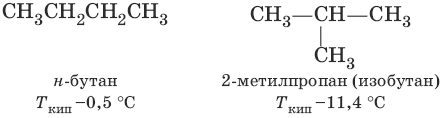
Для алканов, начиная с бутана, существуют структурные изомеры (изомеры строения), различающиеся порядком связывания между атомами углерода, с одинаковым качественным и количественным составом и молекулярной массой, но различающихся по физическим свойствам.
Способы получения алканов
1. СnH2n+2 →400–700 °C→ СpH2p+2 + СmH2m,
n = m + p.
Крекинг нефти (промышленный способ). Алканы также выделяют из природных источников (природный и попутный газы, нефть, каменный уголь).
69) Алканы (предельные углеводороды, парафины) – ациклические насыщенные углеводороды общей формулы СnH2n+2. В соответствии с общей формулой алканы образуют гомологический ряд.
Первые четыре представителя имеют полусистематические названия – метан (CH4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10). Названия последующих членов ряда строятся из корня (греческие числительные) и суффикса -ан: пентан (С5Н12), гексан (С6Н14), гептан (С7Н16) и т. д.
Атомы углерода в алканах находятся в sp3-гибридном состоянии. Оси четырех sp3-орбиталей направлены к вершинам тетраэдра, валентные углы равны 109°28 .
Пространственное строение метана:
энергия С—С связи Ес—с = 351 кДж/моль, длина С—С связи 0,154 нм.
Связь С—С в алканах является ковалентной неполярной. Связь С—Н – ковалентная слабополярная.
Для алканов, начиная с бутана, существуют структурные изомеры (изомеры строения), различающиеся порядком связывания между атомами углерода, с одинаковым качественным и количественным составом и молекулярной массой, но различающихся по физическим свойствам.
Химические свойства алканов
Алканы не способны к реакциям присоединения, т. к. в их молекулах все связи насыщены, для них характерны реакции радикального замещения, термического разложения, окисления, изомеризации.
1. (реакционная способность убывает в ряду: F2 > Cl2 > Br2 > (I2 не идет), R3C• > R2CH• > RCH2• > RCH3•)
2. (реакция Коновалова)
3. CnH2n+2 + SO2 + ½O2 →hν→ CnH2n+1SO3H – алкилсульфокислота
(сульфоокисление, условия реакции: облучение УФ)
4. CH4 →1000 °C→ С + 2Н2; 2CH4 →t>1500 °C→ С2Н2 + ЗН2 (разложение метана – пиролиз)
5. CH4 + 2Н2O →Ni, 1300 °C→ CO2 + 4Н2 (конверсия метана)
6. 2СnH2n+2 + (Зn+1)O2 → 2nCO2 + (2n+2)Н2O (горение алканов)
7. 2н-С4Н10 + 5O2 → 4CH3COOH + 2Н2O (окисление алканов в промышленности; получение уксусной кислоты)
8. н-С4Н10 → изо-С4Н10 (изомеризация, катализатор AlCl3)
70) алкены (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp? гибридизации, и имеют валентный угол 120°
Электронное строение алкенов
Атомы углерода при двойной связи находятся в состоянии sp2гибридизации. Три сигмасвязи, образованные гибридными орбиталями располагаются в одной плоскости под углом 120 о друг к другу. Писвязь образована при перекрывании негибридных 2р орбиталей соседних атомов углерода не в межъядерном пространстве, а вне его, поэтому писвязь менее прочна, чем сигмасвязь. Энергия разрыва пи связи меньше, чем энергия разрыва сигмасвязи. Наличие двух связей между атомами углерода делает расстояние между атомами углерода в двойной связи более коротким, чем расстояние между атомами углерода в простой связи (соотвественно, 0,133 и 0,154 нм)
Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации (часть I, раздел 4.3). Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp3-гибридизации (часть I, раздел 4.3.1). В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (?-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя ?-связи С-Н или С-С.
Четыре ?-связи углерода направлены в пространстве под углом 109о28', что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода.
Номенклатура алкенов
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ен:
2 атома С > этан > этен;
3 атома С > пропан > пропен и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен. Например:
Физические свойства
Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т.п.
В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:
Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
71) Алкены (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp? гибридизации, и имеют валентный угол 120°
Химические свойства
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов, а также способны к аллильному радикальному замещению.
Правило Марковникова объясняется +I-эффектом (положительным индуктивным электронным эффектом) алкильных групп. Например, в молекуле пропилена СН3–СН=СН2, метильная группа СН3, за счет суммирования небольшой полярности трех С–Н связей, является донором электронов и проявляет +I-эффект по отношению к соседним атомам углерода. Это вызывает смещение подвижных p-электронов двойной связи в сторону более гидрогенизированного атома углерода (в группе =СН2), и появлению на нем частичного отрицательного заряда ?-.
Отдельные представители:
Этилен — вызывает наркоз, обладает раздражающим и мутагенным действием.
Пропилен — вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие.
Бутен-2 — вызывает наркоз, обладает раздражающим действием.
72) Алкины (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Получение
Карбидный метод (промышленный способ)
Пиролиз углеводородов (промышленный способ)
Метод прямого синтеза
Электролиз солей непредельных карбоновых кислот
Изомерия
Структурная изомерия
Изомерия положения тройной связи (начиная с С4Н6):
Изомерия углеродного скелета (начиная с С5Н8):
Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом – вдоль линии связи.
73) алкины (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
1) доля s-орбитали в sp-орбитали больше, чем в sp2- и sр3-орбиталях. Радиус sp-орбитали меньше, чем в sp2 и sp3. Это приводит к уменьшению длины связи C?C:
Связь
C-C
C=C
C?C
Длина связи, н
0,15
0,138
0,120
Связь C=C короче, чем C=C. Этим достигается более полное перекрывание р-орбиталей при образовании я-связей в ацетилене. Последнее приводит к тому, что в ацетилене я-связь - более прочна и менее реакционноспособна, чем в этиленовых углеводородах;
2) высокая доля s-орбитали в sp-орбитали приводит к изменению длины и полярности также и связи C-H:
Связь
-C-H
=C-H
?C-H
Длина связи, нм
0,1102
0,1086
0,1057
Дипольный момент, D
0,3
0,6
1,08
Длина связи sp-атома углерода с водородом уменьшается, а дипольный момент растет.
Учитывая эти особенности, можно сделать вывод, что для алкинов, как и для алкенов, характерны реакции присоединения, но протекают они труднее. В отличие от алкенов, алкины способны присоединять как электрофильные, так и нуклеофильные реагенты. Алкины с концевой тройной связью обладают подвижным водородом и C-H кислотными свойствами.
Ацетилениды — соли ацетилена и его производных, в котором один или два атома водорода замещены атомами элементов, более электроположительных, чем углерод. Углерод в ацетиленидах находится в sp-гибридизации.
74) Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод - углеродные связи. Общая формула алкадиенов CnH2n-2.
В зависимости от взаимного расположения двойных связей диены подразделяются на три типа:
1) углеводороды с кумулированными двойными связями, т.е. примыкающими к одному атому углерода. Например, пропадиен или аллен CH2=C=CH2;
2) углеводороды с изолированными двойными связями, т.е разделенными двумя и более простыми связями. Например, пентадиен -1,4 CH2=CH–CH2–CH=CH2;
3) углеводороды с сопряженными двойными связями, т.е. разделенными одной простой связью. Например, бутадиен -1,3 или дивинил CH2=CH–CH=CH2, 2-метилбутадиен -1,3 или изопрен
Реакции
Диеновые углеводороды легко полимеризуются. Реакция полимеризации диеновых углеводородов лежит в основе синтеза каучука.
75) Галогеноуглеводородами называются производные углеводородов, в которых один или несколько атомов водорода заменены на атомы галогена Химические свойства галогеноуглево-дородов
Наибольшее значение для соединений этого класса имеют реакции замещения и отщепления.
1. CH3CH2Br + NaOH (водн. р-р) → CH3CH2OH + NaBr (образование спиртов)
2. CH3CH2Br + NaCN → CH3CH2CN + NaBr (образование нитрилов)
3. CH3CH2Br + NH3 → [CH3CH2NH3]+Br ↔—HBr↔ CH3CH2NH2 (образование аминов)
4. CH3CH2Br + NaNO2 → CH3CH2 NO2 + NaBr (образование нитросоединений)
5. CH3Br + 2Na + CH3Br → CH3—CH3 + 2NaBr (реакция Вюрца)
6. CH3Br + Mg → CH3MgBr (образование магнийорганических соединений, реактив Гриньяра)
7. (дегидрогалогенирование)
76) Арены, или ароматические углеводороды, – циклические соединения, молекулы которых содержат устойчивые циклические группы атомов с замкнутой системой сопряженных связей, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Все связи С—С в бензоле равноценны, их длина равна 0,140 нм. Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф. Кекуле), а все они выровнены (дел окал изованы).
формула Кекуле
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): С6Н5—R, R—С6Н4—R. Общая формула гомологического ряда бензола СnН2n_6 (n > 6). Для названия ароматических углеводородов широко используются тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова «бензол» (корень): С6Н5—CH3 (метилбензол), С6Н5—С2Н5 (этилбензол). Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Для дизамещен-ных бензолов R—С6Н4—R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто– (o-) – заместители соседних атомов углерода кольца (1,2-); мета– (м-) – заместители через один атом углерода (1,3-); пара– (п-) – заместители на противоположных сторонах кольца (1,4-).
Виды изомерии (структурная): 1) положения заместителей для ди-, три– и тетра-замещенных бензолов (например, о-, м- и п-ксилолы); 2) углеродного скелета в боковой цепи, содержащей не менее 3 атомов углерода; 3) заместителей (R), начиная с R=С2Н5.
Способы получения ароматических углеводородов
1. С6Н12 →Pt, 300 °C→ С6Н6 + ЗН2 (дегидрирование циклоалканов)
2. н-С6Н14 →Cr2O3, 300 °C→ С6Н6 + 4Н2 (дегидроциклизация алканов)
3. ЗС2Н2 →С, 600 °C→ С6Н6 (циклотримеризация ацетилена, реакция Зелинского)
77) арены, или ароматические углеводороды, – циклические соединения, молекулы которых содержат устойчивые циклические группы атомов с замкнутой системой сопряженных связей, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Все связи С—С в бензоле равноценны, их длина равна 0,140 нм. Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф. Кекуле), а все они выровнены (дел окал изованы).
Химические свойства ароматических углеводородов
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы, а именно реакции замещения атомов водорода, связанных с циклом. Другие реакции (присоединение, окисление), в которых участвуют делокали-зованные С-С связи бензольного кольца и нарушается его ароматичность, идут с трудом.
1. C6H6 + Cl2 →AlCl3→ C6H5Cl + HCl (галогенирование)
2. C6H6 + HNO3 →H2SO4→ C6H5—NO2 + H2O (нитрование)
3. С6Н6 →H2SO4→ С6Н5—SO3H + H2O (сульфирование)
4. С6Н6 + RCl →AlCl3→ С6Н5—R + HCl (алкилирование)
5. (ацилирование)
6. С6Н6 + ЗН2 →t, Ni→ С6Н12 циклогексан (присоединение водорода)
7. (1,2,3,4,5,6-гексахлороциклогексан, присоединение хлора)
8. С6Н5—CH3 + [О] → С6Н5—COOH кипячение с раствором КMnO4 (окисление алкилбензолов)
78) Спирты? (устар. алкого?ли, англ. alcohols; от лат. spiritus — дух) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, ?OH), непосредственно связанных с насыщенным атомом углерода (находящемся в состоянии sp? гибридизации)[1]. Спирты можно рассматривать как производные воды (H?O?H), в которых один атом водорода замещен на органическую функциональную группу: R?OH.
Классификация спиртов
Спирты классифицируются следующим образом (в скобках приведены примеры)[5]:
По числу гидроксильных групп:
— одноатомные спирты (метанол);
— двухатомные спирты (этиленгликоль);
— трехатомные спирты (глицерин);
— четырёхатомные спирты (пентаэритрит);
— многоатомные спирты (пятиатомный спирт: ксилит).
трёхатомный спирт глицерин четырёхатомный спирт пентаэритрит
В зависимости от насыщенности углеводородного заместителя:
— предельные или насыщенные спирты (бутанол);
— непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт);
— ароматические спирты (бензиловый спирт).
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— алициклические спирты (циклогексанол);
— алифатические или ациклические спирты (этанол).
В зависимости от того, при каком атоме углерода находится гидроксильная группа:
— первичные спирты (пропанол);
— вторичные спирты (изопропиловый спирт);
— третичные спирты (2-метилпропан-2-ол).
Номенклатура
По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
1. Выбирается родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей функциональную группу. Он формирует базовое название (по числу атомов углерода).
2. Родительский углеводород нумеруется в направлении, которое дает суффиксу функциональной группы самое низкое число.
3. Если в соединении помимо функциональной группы имеется другой заместитель, суффикс функциональной группы получает самое низкое число.
4. Если для суффикса функциональной группы получено одно и то же число в обоих направлениях, цепь нумеруется в направлении, которое дает другому заместителю самое низкое число.
5. Если имеется несколько заместителей, они перечисляются в алфавитном порядке.
Строение и особенности химической связи в спиртах
Спирты геометрически подобны молекуле воды. Угол R?O?H в молекуле метанола равен 109°[51]. Гидроксильный кислород находится в состоянии sp? гибридизации:
Получение спиртов
Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, алкилгалогениды, амины, карбонильные соединения, эпоксиды.
реакции окисления — основаны на окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные или активированные C?H связи;
реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
реакции присоединения:
присоединение синтез-газа, формальдегида, оксирана по кратным углеводородным связям;
79)
При замещении в углеводородах ряда метана одного атома водорода на одновалентный радикал гидроксил (водный остаток) ОН получается гомологический ряд одноатомных предельных спиртов, или алкоголей, имеющих общую формулу CnH2n+2O, или CnH2n+1—ОН. Число изомеров, равно как и характер изомерии, для спиртов совершенно такие же, как и для моногалоидных производных углеводородов.
Хим свойства
1. Образование алкоголятов
2. Действие галоидных соединений фосфора.
3. Действие кислот
4. Отнятие воды (дегидратация).
5. Окисление.
Простые эфиры — органические вещества, имеющие формулу R-O-R1, где R и R1 — углеводородные радикалы. Следует однако учитывать, что такая группа может входить в состав других функциональных групп соединений, не являющихся простыми эфирами Простые эфиры — подвижные легкокипящие жидкости, малорастворимые в воде, очень легковоспламеняющиеся. Проявляют слабоосновные свойства (присоединяют протон по атому O).
Метанол(метиловый спирт СН3ОН) – бесцветная жидкость с характерным запахом, горит голубоватым пламенем. Историческое название метанола- древесный спирт- объясняется одним из способов его получения- перегонкой твердых пород дерева. Метанол очень ядовит! Попадание в организм более 50 мл метанола вызывает смерть. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывая гибель зрительного нерва и полную слепоту. Этанол(этиловый спиртС2Н5ОН)- бесцветная жидкость с характерным запахом, хорошо растворяется в воде. Небольшие количества этанола при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. В больших количествах этанол угнетает деятельность головного мозга, вызывая нарушение координации движений. При систематическом употреблении этанола приводит к стойкому снижению продуктивности работы головного мозга гибели клеток печени и замене их соединительной тканью- циррозу печени.
80) тиолы или меркаптаны — органические вещества, сернистые аналоги спиртов, имеющие общую формулу RSH, где R — углеводородный радикал, например, метантиол (метилмеркаптан) (CH3SH), этантиол (этилмеркаптан) (C2H5SH) и т. д.
Меркаптаны получили своё название за способность связывать ионы ртути (от лат. corpus mercurio aptum).
Полярность связи S-H значительно ниже, чем полярность связи O-H, в результате водородные связи между молекулами тиолов значительно слабее, чем у спиртов, и вследствие этого их температура кипения ниже, чем у соответствующих спиртов.
Тиол Температура кипения R-SH, °C Спирт Температура кипения R-OH, °C
H2S - 61 H2O 100
CH3SH 6 CH3OH 65
C2H5SH 37 C2H5OH 78
C6H5SH 168 C6H5OH 181
Тиолы малорастворимы в воде, но хорошо растворяются в этаноле, эфире и других органических растворителях.
Низшие алифатические тиолы являются жидкостями с отвратительным запахом, причём их запах чувствуется в чрезвычайно низких концентрациях — 10?7?10?8 моль/л. Это свойство используется для одорирования бытового газа — добавка меркаптанов к газу позволяет обнаруживать утечки газа в помещениях.
Алифатические тиолы
Старейшим методом получения тиолов является алкилирование гидросульфидов щелочных металлов с первичными и вторичными алкилгалогенидами, в качестве алкилирующих агентов также могут выступать алкилсульфаты или алкилсульфонаты. Реакция идёт по механизму бимолекулярного нуклеофильного замещения SN2 и проводится обычно в спиртовых растворах, поскольку тиолят-ионы также являются сильными нуклеофилами, побочной реакцией является их дальнейшее алкилирование до сульфидов, снижающее выход тиолов; для повышения выхода необходимо использовать большой избыток гидросульфида:
RX + SH? RSH + X?
RSH + SH? RS? + H2S
RS? + RX R2S + X?
(X = Cl, Br, I, ROSO3, RSO3)
Более удобным методом синтеза тиолов является алкилирование тиомочевины с образованием алкилтиурониевых солей и их последующим щелочным гидролизом:
преимуществом этого метода являются легкая очистка перекристаллизацией тиурониевых солей и достаточно высокие общие выходы тиолов.
Своего рода вариацией этого метода, позволяющего получить тиолы без побочного образования сульфидов, является алкилирование с последующим гидролизом ксантогенатов:
C2H5CS2K + RX C2H5CSSR
C2H5CSSR + H2O RSH + C2H5 OH + CSO
или тиоацетатов:
CH3COSK + RX CH3COSR + KX
CH3COSR + H2O RSH + CH3COOH
В условиях кислотного катализа сероводород может присоединяться к алкенам с образованием тиолов:
(CH3)2C=CH2 + H2S (CH3)3CSH
Модификацией этого метода является присоединение тиоуксусной кислоты к алкенам с дальнейшим гидролизом образовавшегося алкилтиоцетата:
RCH=CH2 + CH3COSH RCH2CH2SOCCH3
RCH2CH2SOCCH3 + OH? RCH2CH2SH + CH3COO?
В качестве препаративного метода также применяется взаимодействие спиртов с сульфидом фосфора:
ROH + P4S10 RSH
Ароматические тиолы
Ароматические тиолы могут быть синтезированы восстановлением производных ароматических сульфокислот, так, например, тиофенол синтезируется восстановлением бензолсульфохлорида цинком в кислой среде:
C6H5SO2Cl + [H] C6H5SH
Ароматические тиолы также могут быть синтезированы взаимодействием арилдиазониевых солей с гидросульфидами:
ArN2+ + HS? ArSH
Общие методы
Общим методом синтеза алифатических и ароматических тиолов является взаимодействие реактивов Гриньяра с серой:
RMgX + S8 RSMgX
RSMgX + H2O RSH
Химические свойства
Кислотность
Тиолы обладают слабыми кислотными свойствами, с металлами образуют тиоляты (меркаптиды). Являются значительно более сильными кислотами, чем соответствующие спирты.
Тиол Константа диссоциацииC6H5SH 3,0?10?7
C6H5CH2SH 3,75?10?10
CH2=CH-CH2SH 1,1?10?10
C2H5SH 2,5?10?11
н-C3H7SH 2,26?10?11
трет-C4H9SH 0,89?10?11
Тиолят-анионы высоконуклеофильны, и многие реакции замещения водорода группы -SH протекают через промежуточное образование тиолятов.
Так, тиолы алкилируются под действием алкилгалогенидов:
RS- + R1Hal RSR1 + Hal-
Тиолы в присутствии оснований (пиридина, третичных аминов) ацилируются с образованием S-ацилпроизводных:
RSH + R1COHal RSR1 R1COSR
Нитрозирование тиолов азотистой кислотой или нитрозилхлоридом ведёт к неустойчивым окрашенным нитрозилтиолам (тионитритам):
RSH + HNO2 RSNO + H2O
Эта реакция используется как качественная реакция на тиолы.
Присоединение
Тиолы вступают в реакции присоединения к ацетиленовым, этиленовым и алленовым углеводородам. Реакция может протекать по нуклеофильному, электрофильному либо радикальному механизму.
Окисление
Тиолы окисляются самым широким спектром окислителей (кислород, пероксиды, оксиды азота, галогены и др.). Мягкие окислители (йод, алифатические сульфоксиды, активированный диоксид марганца и т. п.) реагируют с тиолами с образованием дисульфидов:
2RSH RSSR,
которые, в свою очередь, при реакции с хлором образуют тиохлориды:
RSSR' + Cl2 > RSCl + R’SCl
При действии более жёстких окислителей (например, перманганата) сначала образуются сульфиновые кислоты и далее — сульфокислоты:
RSH + [O] [RSO2H] + [O] RSO3H
В случае окисления тетраацетатом свинца (CH3COO)4Pb в присутствии спиртов окисление идёт с образованием сульфинатов — соответствующих эфиров сульфиновых кислот:
RSH + [O] + CH3OH RSO2CH3
В присутствии воды тиолы окисляются хлором до соответствующих сульфонилхлоридов:
RSH + H2O + Cl2 RSO2Cl
Биологическая роль
Смесь тиолов содержится в веществе, выделяемом скунсами, а также в продуктах гниения белков.
Аминокислота цистеин HSCH2CH(NH2)COOH содержащая меркаптогруппу, входит в состав многих белков, окисление цистеина с образованием дисульфидных мостиков в ходепосттрансляционной модификации белков является важнейшим фактором при формировании их третичной структуры, высокая механическая прочность кератинов обусловлена, в том числе, и высокой степенью сшитости за счёт образования большого количества дисульфидных мостиков: так, например, содержание цистеина в кератине волоса человека, составляет ~14 %.
Трипептид глутатион, в состав которого также входит цистеин, является коферментом глутатионпероксидаз и играет важную роль в окислительно-восстановительных процессах в живых организмах.
Также существенное биологическое значение имеет метаболическое нитрозирование тиолов: глутатион и цистеиновые остатки белков при взаимодействии с активными формами азотаобразуют S-нитрозопроизводные, которые являются физиологическим депо оксида азота.
Применение
За счёт сильного неприятного запаха тиолы, в частности, этантиол, используются для добавления во вредные газы, не имеющие запаха, для обнаружения утечки. Согласно правиламРостехнадзора, запах этантиола в одорированном природном газе появляется при концентрации последнего не более 20 % (об.) от нижнего предела взрываемости.
81) Фенолы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углеродаароматического кольца. По числу ОН-групп различают:
? одноатомные фенолы (аренолы): фенол (C6H5OH) и его гомологи;
? двухатомные фенолы (арендиолы): гидрохинон, пирокатехин, резорцин;
? трёхатомные фенолы (арентриолы): пирогаллол, флороглюцин, гидроксигидрохинон и т. д.
Изомерия
Возможны 2 типа изомерии:
? изомерия положения заместителей в бензольном кольце;
? изомерия боковой цепи (строения алкильного радикала и числа радикалов).
[править]Электронное строение
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа — OH — положительным. Дипольный момент направлен в сторону бензольного кольца.
Электронное строение фенола
Как известно, гидроксильная группа -OH является заместителем I рода, то есть она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара-положениях). Это обусловлено тем, что одна из неподелённых пар электронов атома кислорода OH-группы вступает в сопряжение с ?-системой бензольного кольца. Смещение неподелённой пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи O-H. Таким образом, имеет место взаимное влияние атомов и атомных групп в молекуле фенола. Это взаимное влияние отражается в свойствах фенола.[1]
Во-первых, повышается способность к замещению атомов водорода в орто- и пара-положениях бензольного ядра, и в результате реакций замещения обычно образуются тризамещённые производные фенола.
Во-вторых, увеличение полярности связи O-H под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекулы фенола диссоциируют в водных растворах по кислотному типу.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
[править]В живых организмах
Фенол является окончанием боковой группы стандартной аминокислоты тирозина, и поэтому входит в состав практически каждой белковой молекулы[источник не указан 219 дней].
[править]Химические свойства
[править]1. Реакции с участием гидроксильной группы
Кислотные свойства
1. Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода;
2. Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов);
3. Взаимодействие с активными металлами с образованием фенолятов (образующиеся в результате реакций 2) и 3) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов, следовательно, фенол — ещё более слабая кислота, чем угольная).
При взаимодействии фенолятов с галогенпроизводными образуются простые и сложные эфиры (реакция Фриделя — Крафтса).
[править]2. Реакции с участием бензольного кольца
Реакции замещения
1. Галогенирование (взаимодействие с галогенами)
2. Нитрование (взаимодействие с азотной кислотой)
3. Сульфирование (взаимодействие с серной кислотой)
Реакции присоединения
1. Гидрирование (восстановление водородом до циклогексанола)
Качественные реакции на фенолы
В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления синильной кислоты
[править]Способы получения
1. Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи(образуются феноляты), а затем — кислотой.
1. Сплавление аренсульфокислот со щелочью:
C6H5-SO3Na + NaOH > C6H5-OH + Na2SO3
1. Взаимодействие галогенпроизводных ароматических УВ со щелочами:
C6H5-Cl + NaOH > C6H5-OH + NaCl или с водяным паром: C6H5-Cl + H2O > C6H5-OH + HCl
[править]Применение фенолов
Фенолы применяются в производстве синтетических смол, пластмасс, полиамидов и других полимеров, лекарственных препаратов, красителей, поверхностно-активных веществ,антиоксидантов, антисептиков, взрывчатых веществ.
82) Фенолформальдегидные смолы (PF) — синтетические реактопласты или термореактопласты, жидкие или твердые олигомерные продукты поликонденсации фенола с формальдегидом в щелочной или кислой среде (бакелиты, новолачные и резольные смолы), что соотвественно влияет на их свойства. Используются для получения в качестве связующего компонента в производстве наполненных пресс-композиций с различными наполнителями (целлюлоза, стекловолокно, древесная мука) (древесно-волокнистых и древесностружечных плит), клеев, пропиточных и заливочных композиций (для фанеры, тканых и наполенных волокном материалов). Растворимы в водных растворах щелочей и полярных растворителях, после отвержения превращаются в густосшитые полимеры аморфной микрогетерогенной структуры.
Содержание
[показать][править]Свойства
? механическая устойчивость, прочность
? коррозионная устойчивость
? высокие электроизоляционные свойства
? отличная растворимость в алифатических и ароматических углеводородах, хлорсодержащих растворителях и кетонах
Применение
Применяются для получения пластических масс (отвержденные смолы называют резитами, отвержденные в присутствии нефтяных сульфокислот — карболитами, молочной кислоты — неолейкоритами), синтетических клеев, лаков, выключателей, тормозных накладок, подшипников, так же широко используется в изготовление шаров для бильярда.
Экологические аспекты
В производстве применяются токсичные материалы. И фенол, и формальдегид ядовиты и огнеопасны.[1] Формальдегид обладаетканцерогенным действием.
Фенолформальдегидные смолы оказывают вредное воздействие на кожу, они вызывают дерматиты и экземы.[1] Неотверженная фенолформальдегидная смола может содержать до 11% свободного фенола.[2]
При отвержении фенол-формальдегидных смол в пластмассы (фенопласты) происходит сшивка олигомерных фрагментов смолы с участием содержащегося в ней свободного фенола, при этом содержание фенола, инкорпорированного в фенопласте, снижается до следовых количеств; санитарными нормативами РФ регламентируются допустимые количества миграции фенола и формальдегида для изделий из фенопластов; в частности, для изделий, контактирующих с пищевыми продуктами для фенола - 0.05 мг/л, для формальдегида - 0.1 мг/л[3].
