
- •Основные положения молекулярно-кинетической теории вещества. Газы, жидкости и твердые тела. Статистический и термодинамический методы исследования.
- •Термодинамические параметры. Состояние термодинамического равновесия. Уравнения состояния термодинамической системы.
- •21. Тепловое излучение. Энергетическая светимость. Спектральная плотность энергетической светимости. Спектральная поглощательная способность. Понятие ачт.
- •22. Законы тепл. Излучения. Закон Кирхгофа для тепл.Излучения. Распределение энергии в спектре излучения ачт. Закон Стефана-Больцмана. Закон смещения Вина.
- •23. Формулы Рэлея-Джинса и Вина для излучения ачт. Гипотеза Планка
- •24. Фотоэффект. З-ны внешнего фотоэффекта. Фотоны. Ур-ие Эйнштейна для вн. Фотоэффекта.
- •25. Корпускулярно-волновой дуализм. Энергия, масса и импульс фотона. Давление света. Эффект Комптона.
- •26. Линейчатый спектр атома водорода. Формула Бальмера
- •27. Модели атома. Модель Томсона. Опыты Резерфорда. Планетарная модель атома.
- •29. Спонтанное и вынужденное излучение. Оптические квантовые генераторы.
- •30. Рентгеновское излучение. Рентгеновская трубка. Тормозное излучение и его спектр. Характеристическое излучение и его спектр.
- •31. Гипотеза де Бройля. Опыты Дэвиссона и Джермера.
- •32. Соотношение неопределенностей Гейзенберга.
- •33. Волновая функция и её свойства. Движение свободной частицы.
- •34. Уравнение Шредингера. Квантовые состояния.
- •35. Микрочастица в одномерной потенциальной яме.
- •36. Атом водорода в квантовой механике.
- •37. Модели атомного ядра. Состав ядра. Ядерные силы.
- •38. Дефект массы. Энергия связи нуклонов ядра.
- •39. Радиоактивность. Закон радиоактивного распада. Закономерность α,β,γ распада. Искусственная радиоактивность.
- •40. Ядерные реакции. Ядерные реакции деления и синтеза.
- •41. Физические основы ядерной энергетики. Ядерный реактор.
- •42. Проблемы управляемого термоядерного синтеза.
- •43.Прохождение заряженных частиц и гамма излучения через вещ-во. Элементы дозиметрии.
- •44. Виды взаимодействий в природе. Элементарные частицы. Классификация элементарных частиц. Кварки.
Основные положения молекулярно-кинетической теории вещества. Газы, жидкости и твердые тела. Статистический и термодинамический методы исследования.
Основные положения молекулярно-кинетической теории вещества:
-Все тела состоят из частиц;
-Частицы находятся в беспорядочном движении;
-Движение никогда не прекращается;
-Частицы взаимодействуют между собой (притягиваются или отталкиваются).
Идеальный газ – газ, взаимодействием частиц которого можно пренебречь, а объем стремится к 0.
Жи́дкость — одно из агрегатных состояний вещества, оно способно менять форму неограниченное число раз под действием напряжений.
Твёрдое тело —это одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости,газов, плазмы) стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия.
Статистический и термодинамический метод исследования используется в молекулярной физике и термодинамике.
Статистический метод основан на том, что свойства макроскопической системы в конечном счете определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т.п.). Вероятностный метод.
Статистические параметры:
n-концентрация;
mo
– масса одной молекулы; U-
средняя скорость; ω
– средняя кинетическая энергия движения
частиц.

Термодинамический метод не рассматривает микропроцессы, которые лежат в основе этих превращений. Предусматривает характеристику системы как единое целое. p-давление; T-температура; ρ-плотность; V-объем; m-масса ядра.
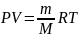
Термодинамические параметры. Состояние термодинамического равновесия. Уравнения состояния термодинамической системы.
Термодинамическая система – система одного или нескольких тел, способных обмениваться энергией или веществом между собой. Система находится в равновесии если параметры во всех её точках остаются постоянными.
Термодинамический процесс – процесс, при котором в системе меняется хотя бы 1 параметр.
Термодинамические параметры – совокупность физических величин, характеризующих свойства термодинамической системы (температура, давление, удельный объем).
p-давление; T-температура; ρ-плотность; V-объем; m-масса ядра.
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Удельный объем – объем единицы массы.
Давле́ние — физическая величина, равная силе, действующей на единицу площади поверхности перпендикулярно этой поверхности.
Уравнение состояния идеального газа:
R
= 8,31 Дж/моль*К,
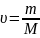 -
количество вещества
-
количество вещества
 n
– концентрация в единицы объема,
k=1,38*10-23
Дж/К – Постоянная Боцмана.
n
– концентрация в единицы объема,
k=1,38*10-23
Дж/К – Постоянная Боцмана.
3. Кинетическая теория идеального газа. Основные законы классической статистики. Основное ур-ие кинетической теории идеального газа. Статистический смысл термодинамической температуры.
Молекулярно-кинетическая теория является статистической теорией, то есть теорией, рассматривающей поведение систем, состоящих из огромного числа частиц (атомов и молекул), на основе вероятностных моделей.
Так как число молекул огромное количество, то можно применить законы статистики и найти определенные закономерности для всего вещества в целом.
Основные положение молекулярно-кинетической теории:
- все тела состоят из частиц;
- эти частицы находятся в беспорядочном движении;
- это движение никогда не прекращается, частицы взаимодействуют между собой (притягиваются или отталкиваются)
Кинетическая теория газов объясняет неравновесные свойства газов (явления переноса энергии, массы, импульса) на основе законов движения и взаимодействия молекул. Она основана на предположении, что молекулы в газах находятся на расстояниях, значительно превышающих их размер. Так как силы взаимодействия между электрически нейтральными атомами являются очень короткодействующими, то взаимодействие молекул происходит лишь при их непосредственном сближении — при столкновениях. Взаимодействия между молекулами идеального газа отсутствуют; его энергия зависит только от температуры.
Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие.
Тогда давление газа, оказываемое им на стенку сосуда равно:
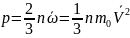 ,
где
,
где
 - квадрат средней
квадратичной скорости движения молекул;
- квадрат средней
квадратичной скорости движения молекул;
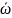 - средняя
кинетическая энергия поступательного
движения молекулы;
- средняя
кинетическая энергия поступательного
движения молекулы;
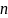 - концентрация молекул (
- концентрация молекул (
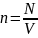 );
);
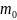 - масса одной молекулы. ( всё выше
перечисленное Статистические Параметры!
)
- масса одной молекулы. ( всё выше
перечисленное Статистические Параметры!
)
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа.
Статистический метод – вероятностный метод. Термодинамический метод – предусматривает характеристику системы как единое целое.
Термодинамическая система – система одного или нескольких тел, способных обмениваться энергией или веществом между собой.
Термодинамический процесс – это процесс, при котором в системе меняется хотя бы один параметр.
Система находится в равновесии, если параметры во всех её точках остаются постоянными.
4. Равновесное распределение молекул в потенциальном поле. Барометрическая формула. Статистическое распределение Больцмана.
При выводе основного уравнения молекулярно-кинетической теории газов и максвелловского распределения молекудл по скоростям предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объёму. Однако молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул - с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает.
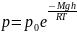 – барометрическая
формула. Она позволяет найти атмосферное
давление в зависимости от высоты или,
измерив давление, найти высоту. (
– барометрическая
формула. Она позволяет найти атмосферное
давление в зависимости от высоты или,
измерив давление, найти высоту. (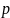 - давление на высоте h;
M
– молярная масса )
- давление на высоте h;
M
– молярная масса )
Прибор для определения высоты над земной поверхностью называется высотомером (или альтиметром). Его работа основана на использовании барометрической формулы. Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
Барометрическую
формулу можно преобразовать, если
воспользоваться выражением
 .
Так как
.
Так как
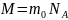 (
( -
постоянная Авогадро,
- масса одной молекулы), а
-
постоянная Авогадро,
- масса одной молекулы), а
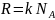 ,
то
,
то
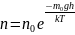 ,
где
,
где
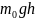 =
П – потенциальная энергия молекулы в
поле тяготения, т.е.
=
П – потенциальная энергия молекулы в
поле тяготения, т.е.
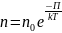
Данное выражение называется распределением Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
5. Функция распределения. Распределение Максвелла молекул газа по скоростям. Наиболее вероятная, средняя и средняя квадратичная скорости теплового движения молекул.
З акон
Максвелла описывается некоторой функцией
f(v),
называется функцией распределения
молекул по скоростям. Если разбить
диапазон скоростей молекул на малые
интервалы, равные dv,
то на каждый интервал скорости будет
приходиться некоторое число молекул
dN(v),
имеющих скорость, заключенную в этом
интервале. Функция f(v)
определяет относительное число молекул
dN
(v)
/N
, скорости которых лежат в интервале от
(v)
до v+dv.
акон
Максвелла описывается некоторой функцией
f(v),
называется функцией распределения
молекул по скоростям. Если разбить
диапазон скоростей молекул на малые
интервалы, равные dv,
то на каждый интервал скорости будет
приходиться некоторое число молекул
dN(v),
имеющих скорость, заключенную в этом
интервале. Функция f(v)
определяет относительное число молекул
dN
(v)
/N
, скорости которых лежат в интервале от
(v)
до v+dv.
N – полное число молекул;
dN – число молекул обладающих скоростью (v);
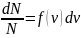 – доля молекул
скорости которых лежат в пределе dv
– доля молекул
скорости которых лежат в пределе dv
f(v) – функция распределения молекул газа по скоростям ( Распределение Максвелла)

Наиболее вероятностная скорость – скорость, при которой функция распределения молекул идеального газа по скоростям максимально.
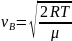
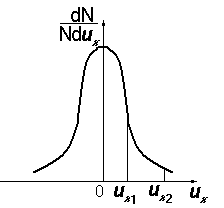
Средняя
скорость
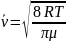
Средняя
квадратичная скорость
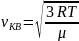
6. Средняя длина свободного пробега и среднее число столкновений молекул газа. Зависимость длины свободного пробега от параметров газа.
Молекулы газа, находятся в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекул проходит некоторый путь L – длина свободного пробега.
d- эффективный диаметр молекул
σ=πd2 – эффективное сечение молекулы
 – средняя длина
свободного пробега
– средняя длина
свободного пробега
ϑ
– среднее число столкновений молекул
газа
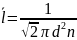 ;
;
;
;

Вакуум в зависимости от размера сосуда а бывает:
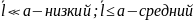 ;
;
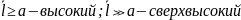
7.Диффузия. Закон Фика. Связь коэффициента диффузии со средней длиной свободного пробега молекул и его зависимость от параметров газа.
Диффузия - процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму.
Закон Фика показывает связь между коэффициентом диффузии, со средней длиной свободного пробега молекул и его зависимость от параметров газа.
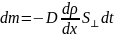
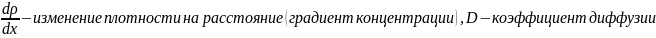
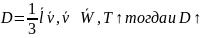
8.Теплопроводность и вязкость. Законы Фурье и Ньютона. Зависимость коэффициентов вязкости и теплопроводности от параметров газа.
Теплопроводность - это перенос тепловой энергии структурными частицами вещества (молекулами, атомами, ионами) в процессе их теплового движения.
Вязкость - это перенос тепловой энергии структурными частицами вещества (молекулами, атомами, ионами) в процессе их теплового движения.
Закон
теплопроводности Фурье:
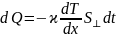
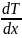 – градиент температуры,
– градиент температуры,
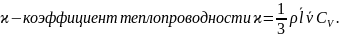
Закон Ньютона(закон вязкости).
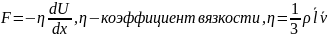 ;
;
9. Внутренняя энергия газа. Степени свободы молекулы, закон Больцмана о равномерном распределении энергии по степеням свободы.
Внутренняя энергия газа
U = Uк + Uп , Дж
∆U = U2 – U1
Для идеального газа U = Uк , U = f(t)
Степени свободы молекулы. Закон Больцмана.
На каждую степень свободы (постоянную, вращательную и колебательную) в среднем приходится одинаковая кинетическая энергия, равная kT/2.
I – число степеней свободы.
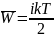 – средняя энергия
молекул.
– средняя энергия
молекул.
I = iпост + iвр + 2iкол
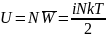
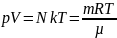
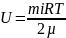 - внутренняя энергия
произвольной массы газа m
- внутренняя энергия
произвольной массы газа m
Одноатомарная молекула – 3 пост.степени свободы
Двухатомарная молекла – 5 степеней свободы = 3 пост + 2 вр
Трёхатомарная молекла – 6 степеней свободы = 3 пост + 3 вр
10. Работы расширения газа, теплоты, первое начало термодинамики. Теплоемкость вещества, уравнение Майера.
Работа расширения газа
А – работа
Формы передачи энергии: механическая (работа А) ; теплота Q
А = мера изменения механической энергии, переданной от одного тела к другому.
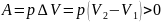
A<0 – при сжатии
Теплота
Теплота – количество энергии, переданной от одного тела к другому в процессе теплопередачи.
Колличество теплоты, переданное системе расходуется последовательно на изменение её внутренней энергии и совершение механической работы.
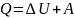 – первое начало
термодинамики
– первое начало
термодинамики
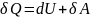
Q>0, если подводится. Q <0, если отводится.
Теплоёмкость вещества. Уравнение Майера.
Теплоёмкость вещества – количество теплоты, необходимое для изменения температуры тела на один Кельвин.
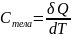 (Дж/К)
(Дж/К)
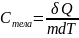 (Дж/кгК)
(Дж/кгК)


Первое начало термодинамики:

Cv (V=const) - изохорная
Cp (p=const) - изобарная
Cp > Cv
 – уравнение Майера
– уравнение Майера
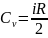
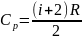
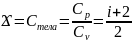
11.Применение первого начала термодинамики к изопроцессам в идеальном газе.
И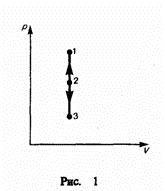 зохорный
процесс (V=const).
Диаграмма этого процесса (изохора)
в координатах р, V изображается прямой,
параллельной оси ординат (рис. 1), где
процесс 1—2 есть изохорное нагревание,
а 1—3 — изохорное охлаждение. При
изохорном процессе газ не совершает
работы над внешними телами, т. е.
зохорный
процесс (V=const).
Диаграмма этого процесса (изохора)
в координатах р, V изображается прямой,
параллельной оси ординат (рис. 1), где
процесс 1—2 есть изохорное нагревание,
а 1—3 — изохорное охлаждение. При
изохорном процессе газ не совершает
работы над внешними телами, т. е.

Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии: δQ=dU Для произвольной массы
газа: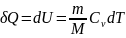

И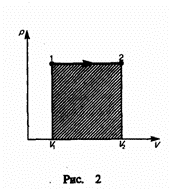 зобарный
процесс (p=const).
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
зобарный
процесс (p=const).
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
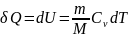
и
равна площади заштрихованного
прямоугольника (рис. 2). Если использовать
уравнение Менделеева-Клапейрона для
выбранных нами двух состояний, то
 откуда
откуда
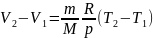 Тогда
выражение (2) для работы изобарного
расширения примет вид
Тогда
выражение (2) для работы изобарного
расширения примет вид
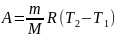
Изотермический
процесс (T=const).
Изотермический процесс описывается
законом Бойля—Мариотта:
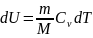
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, которая расположена на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя
из формул для работы газа и уравнения
Менделеева-Клайперона найдем работу
изотермического расширения газа:
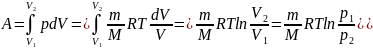
Так
как при Т=const внутренняя энергия идеального
газа не изменяется:
 то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса δQ=δA т. е. все количество теплоты,
сообщаемое газу, расходуется на совершение
им работы против внешних сил:
то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса δQ=δA т. е. все количество теплоты,
сообщаемое газу, расходуется на совершение
им работы против внешних сил:

12.Адиабатический процесс. Уравнение Пуассона и показатель адиабаты. Термодинамические функции состояния.
Адиабатическим называется процесс, при котором отсутствует теплообмен (δQ=0) между системой и окружающей средой. Адиабатическим процессами можно считать все быстропротекающие процессы.
Из первого начала термодинамики (δQ=dU+δA) для адиабатического процесса следует, что δA=- dU (1)т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя
формулы δA=pdV и CV=dUm/dT,
для произвольной массы газа перепишем
уравнение (1) в виде:
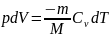 (2) применив
дифференцирование уравнение состояния
для идеального газа
(2) применив
дифференцирование уравнение состояния
для идеального газа
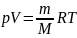 получим:
получим:
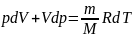 (3)
(3)
Исключим
из (2) и (3) температуру Т. 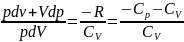 Разделив
переменные и учитывая, что
Разделив
переменные и учитывая, что
 , найдем
, найдем
 .
Проинтегрируя
это уравнение в пределах от p1 до
p2 и
соответственно от V1 до
V2,
и потенцируя, придем к выражению
.
Проинтегрируя
это уравнение в пределах от p1 до
p2 и
соответственно от V1 до
V2,
и потенцируя, придем к выражению 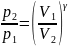 или
или
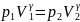
Так
как состояния 1 и 2 выбраны произвольно,
то можно записать
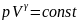 , полученное
выражение есть уравнение
адиабатического процесса,
называемое также уравнением
Пуассона.
, полученное
выражение есть уравнение
адиабатического процесса,
называемое также уравнением
Пуассона.
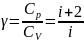 называется показателем
адиабаты (или коэффициентом
Пуассона).
называется показателем
адиабаты (или коэффициентом
Пуассона).
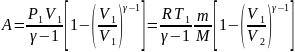 работа при адиабатическом процессе.
работа при адиабатическом процессе.
13. Круговые процессы. Обратимые и необратимые процессы. Тепловая машина. КПД теплового двигателя.
Круговым процессом(циклом) называется такой процесс, в результате которого термодинамическая система возвращается в исходное состояние.
Обратимым процессом называют такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Обратимым может быть только равновесный процесс.
В том случае, когда после завершения прямого и обратного процессов система вернулась в первоначальное состояние и в окружающей среде остались изменения, процесс является необратимым. Очевидно, что все процессы в природе необратимые.
Тепловая машина-устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Идеальная тепловая машина — машина, в которой произведённая работа и разница между количеством подведённого и отведённого тепла равны. Работа идеальной тепловой машины описывается циклом Карно.
При работе часть тепла Q1 передается от нагревателя к рабочему телу, а затем часть энергии Q2 передается холодильнику, который охлаждает машину КПД тепловой машины считается по формуле (Q1-Q2/Q1)х100
Периодически действующий двигатель, совершающий работу за счет получаемого извне тепла, называется тепловой машиной.
Коэффициент полезного действия (КПД) теплового двигателя рассчитывается как отношение работы, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
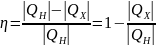
14. Обратимый цикл Карно. Теорема Карно. КПД реальной тепловой машины.
Обратимый цикл Карно имеет самый высокий термический КПД среди возможных циклов, осуществляемых в одном и том же интервале температур. Исключение составляют лишь регенеративные циклы, в которых термический КПД такой же, как у цикла Карно.
Обратимый цикл для идеального газа из N молекул состоит из трех процессов: изотермического расширения от V до V2, изобарического сжатия, адиабатического сжатия.
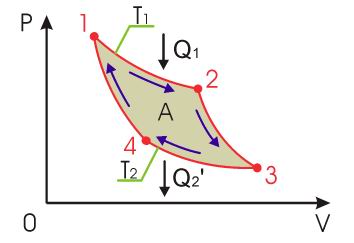
Обратимый
цикл Карно состоит из двух изотерм,
описывающих процесс теплопередачи от
нагревателя к рабочему телу и от рабочего
тела к холодильнику, и двух адиабат,
описывающих расширение и сжатие рабочего
тела в тепловой машине (см. рис. ).
Температура нагревателя считается
равной , а температура холодильника -
соответственно . При этом температуры
нагревателя и холодильника постоянны,
что должно обеспечиваться бесконечно
большой теплоемкостью используемых
тепловых резервуаров.
Первая теорема (более известна как формула Карно) Пусть дан произвольный треугольник ABC. Тогда сумма алгебраических расстояний (англ.) от центра описанной окружности D до сторон треугольника ABC будет равна DF+DG+DH=r , где r — радиус вписанной окружности, а R — описанной. Знак расстояния принимается отрицательным тогда и только тогда, когда отрезок DX (X = F, G, H) целиком лежит вне треугольника.
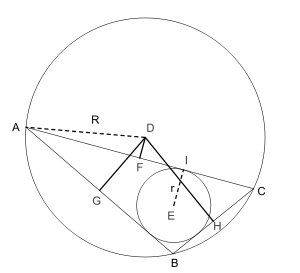
Вторая теорема (известная также как критерий Карно)
Пусть
дан треугольник АВС и точки А1, В1, С1 на
плоскости. Тогда перпендикуляры,
опущенные из А1, В1, С1 на ВС, АС, ВС
соответственно, пересекаются в одной
точке тогда и только тогда, когда

15. Понятие энтропии. Изменение энтропии в однонаправленных процессах. Второе начало термодинамики. Третье начало термодинамики.
Термодинамическая энтропия — термодинамическая функция, характеризующая меру неупорядоченности термодинамической системы, то есть неоднородность расположения и движения ее частиц.
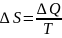 .(то
есть тепло, переданное системе, при
постоянной температуре)
.(то
есть тепло, переданное системе, при
постоянной температуре)
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.Второе начало термодинамики (в формулировке неубывания энтропии) иногда используется критиками эволюционной теории с целью показать, что развитие природы в сторону усложнения невозможно. Однако подобное применение физического закона является некорректным, так как энтропия не убывает только в замкнутых системах (сравн. с диссипативной системой), в то время как живые организмы и планета Земля в целом являются открытыми системами.
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение):
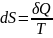
Согласно
третьему началу термодинамики,
при 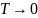 значение
значение 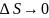
Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достичь ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться, поэтому третье начало термодинамики иногда формулируют как принцип недостижимости абсолютного нуля температуры.
16. Силы межмолекулярного взаимодействия в реальном газе. Уравнение Ван-дер-Ваальса. Внутренняя энергия реального газа.
При рассмотрении реальных газов — газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях £ 10–9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
В основе межмолекулярного взаимодействия лежат силы электромагнитной природы, эти силы на
малых расстояниях имеют характер отталкивания, а на больших – характер притяжения. Впервые
взаимодействие между атомами и молекулами рассматривал и учитывал при определении уравнения состояния реального газа И. Ван-дер-Ваальс (Иоханнес Дидерик Ван дер Ваальс, нидерландский физик, 1837–1923, Нобелевская премия в 1910 г. за работы, содержащие уравнения агрегатных состояний газов и жидкостей), поэтому межмолекулярное взаимодействие часто называют взаимодействием Ван-дер-Ваальса.
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа
Ван-дер-Ваальса оно имеет вид:
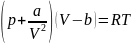
где
p— давление,
V— молярный объём,
T— абсолютная температура,
R— универсальная газовая постоянная.
Для ![]() молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:
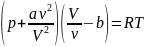
где
V— объём,
Внутренняя энергия газа Ван-дер-Ваальса складывается из его кинетической энергии (энергии теплового движения молекул) и только что нами посчитанной потенциальной. Так, для одного моль газа:
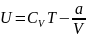
где Cv— молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
17. Изотермы реального газа. Критические параметры. Фазовые переходы реального газа. Насыщенный пар и его зависимость от температуры. Критическая температура. Конденсированное состояние.
Изотермы
С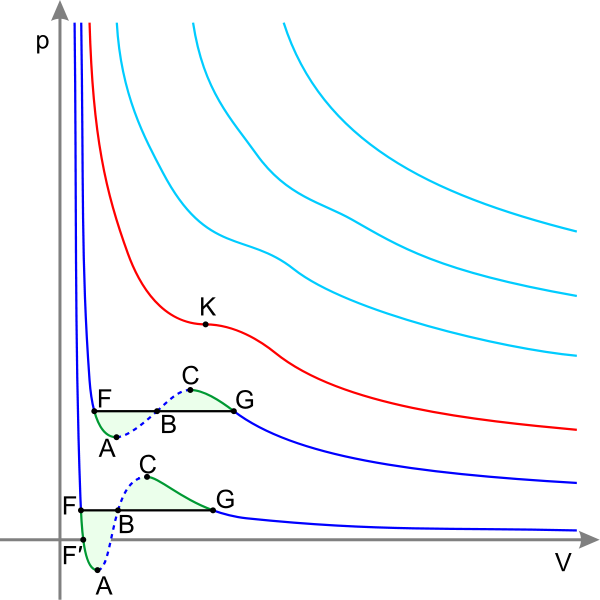 иние
— изотермы при температуре ниже
критической. Зелёные участки на них
— метастабильные
состояния.
Участок
левее точки F — нормальная жидкость.
Точка
F — точка
кипения.
Прямая
FG — равновесие жидкой и газообразной
фазы.
Участок
FA — перегретая
жидкость.
Участок
F′A — растянутая
жидкость (p<0).
Участок
AC — аналитическое
продолжение изотермы,
физически невозможен.
Участок
CG — переохлаждённый
пар.
Точка
G — точка
росы.
Участок
правее точки G — нормальный газ.
Площади
фигуры FAB и GCB равны.
Красная
— критическая
изотерма.
K
— критическая
точка.
Голубые
— сверхкритические изотермы
иние
— изотермы при температуре ниже
критической. Зелёные участки на них
— метастабильные
состояния.
Участок
левее точки F — нормальная жидкость.
Точка
F — точка
кипения.
Прямая
FG — равновесие жидкой и газообразной
фазы.
Участок
FA — перегретая
жидкость.
Участок
F′A — растянутая
жидкость (p<0).
Участок
AC — аналитическое
продолжение изотермы,
физически невозможен.
Участок
CG — переохлаждённый
пар.
Точка
G — точка
росы.
Участок
правее точки G — нормальный газ.
Площади
фигуры FAB и GCB равны.
Красная
— критическая
изотерма.
K
— критическая
точка.
Голубые
— сверхкритические изотермы
Критические параметры.
Критические температура и давление. Газы могут быть превращены в жидкость сжатием при условии, что температура не превышает определенного для каждого газа значения. Температура, при которой и выше которой данный газ не может быть сжижен никаким повышением давления, называется критической Ткр. Давление, при котором и выше которого повышением температуры нельзя испарить жидкость, называется критическим ркр. Объем газа, соответствующий критической температуре, называется критическим Vкр, а состояние газа, отвечающее критической температуре, критическому давлению и критическому объему, — критическим состоянием газа. При критическом состоянии плотность пара становится равной плотности жидкости
Фазовые переходы. Насыщенный пар и его зависимость от температуры.
Переход из одного состояния вещества в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. п.) при определенных условиях способны превращаться в жидкости. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температурыTкр. Например, для воды критическая температура равна 647,3 K, для азота 126 K, для кислорода 154,3 K. При комнатной температуре (≈ 300 K) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе.
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
Критическая температура— такая температура, при которой плотность и давление насыщенного пара становится максимальными, а плотность жидкости, находящейся в динамическом равновесии с паром, становится минимальной.
Конденсированное состояние вещества, твёрдое и жидкое состояния вещества. В отличие от газообразного состояния, у вещества в конденсированном состоянии существует упорядоченность в расположении частиц (ионов, атомов, молекул). Кристаллические твёрдые тела обладают высокой степенью упорядоченности — дальним порядком в расположении частиц. Частицы жидкостей и аморфных твёрдых тел располагаются более хаотично, для них характерен ближний порядок. Свойства веществ в конденсированном состоянии определяются их структурой и взаимодействием частиц
18 .Возникновение жидкого и твердого состояния из газа. Агрегатное состояние вещества как следствие соотношения его потенциальной и кинетической энергии. Испарение и кипение жидкости. Зависимость температуры кипения от давления. Фазовые равновесия и фазовые переходы. Уравнение Клапейрона-Клаузиуса. Тройная и критическая точки.
Испарение и кипение жидкости
Кипе́ние — процесс парообразования в жидкости (переход вещества из жидкого в газообразное состояние), с возникновением границ разделения фаз. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества.
Кипение является фазовым переходом первого рода. Кипение происходит гораздо более интенсивно, чем испарение с поверхности, из-за образования очагов парообразования, обусловленных как достигнутой температурой кипения, так и наличием примесей.
На процесс образования пузырьков можно влиять с помощью давления, звуковых волн, ионизации. В частности, именно на принципе вскипания микрообъёмов жидкости от ионизации при прохождении заряженных частиц работает пузырьковая камера.
Испаре́ние — процесс перехода вещества из жидкого состояния в газообразное (пар). Процесс испарения является обратным процессу конденсации (переход из парообразного состояния в жидкое. Испарение(парообразование), переход вещества из конденсированной (твердой или жидкой) фазы в газообразную (пар); фазовый переход первого рода.
Существует более развёрнутое понятие испарения в высшей физике.
Испаре́ние — это процесс, при котором с поверхности жидкости или твёрдого тела вылетают (отрываются) частицы (молекулы, атомы), при этом Ek > Eп.
Зависимость температуры кипения от давления
Из приведенных рассуждений видно, что с уменьшением внешнего давления должна понижаться и температура кипения жидкости.
Принято считать, что точке кипения воды при нормальном атмосферном давлении соответствует температура 100º С. Однако жителям высокогорных селений хорошо известен факт закипания воды при значительно более низкой температуре. Так на вершине Эльбруса вода закипает уже при 82º С. Физическим фактором, ответственным за изменение температуры кипения, является уменьшение внешнего давления в высокогорных районах. Вода кипит при 100º С только при давлении 760 мм Hg. При давлении 0,5 атм она закипает при 82º С, а при давлении 10-15 мм Hg вода закипает в интервале температур 10-15º С. Можно получить даже "кипяток", имеющий температуру замерзающей воды. Для этого придется понизить внешнее давление до 4,6 мм Hg.
Отмечая факт понижения температуры кипения с уменьшением давления, естественно ожидать, что с повышением давления температура кипения будет повышаться. Действительно, при давлении 15 атм кипение воды начинается при 200º С, а давление в 80 атм вызывает кипение воды даже при 300º С. Итак, определенному внешнему давлению соответствует своя температура кипения, или каждой температуре кипения соответствует вполне определенное давление. Напомним, что это давление называется упругостью пара (кипение начинается, когда упругость насыщенного пара внутри пузырьков жидкости равна внешнему давлению).Упругость пара с изменением температуры меняется очень быстро, а температура кипения с изменением давления - довольно медленно.
Фазовые равновесия и фазовые переходы
Фазовое равновесие, сосуществование термодинамически равновесных фаз гетерогенной системы. Является одним из основных случаев термодинамического равновесия и включает в себя условия равенства температуры всех частей системы (термическое равновесие), равенства давления во всем объеме системы (механическое равновесие) и равенство химических потенциалов каждого компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f, находящихся одновременно в равновесии, связано с числом компонентов k, числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние температуры и давления, n = 2), и числом термодинамических степеней свободы v уравнением: v = k + 2 - f (см. Фаз правило).
В общем виде условие фазовое равновесие, согласно принципу равновесия Гиббса, сводится к максимуму энтропии Sсистемы при постоянстве внутренней энергии U, общего объема V и числа молей каждого компонента ni-. Этот принцип можно выразить также как условие минимума любого из термодинамических потенциалов: внутренней энергии U, энтальпии H, энергии Гиббса G, энергии Гельмгольца А при условии постоянства соответствующих параметров состояния, включая число молей каждого компонента. возможны 4 вида двухфазных равновесий: жидкость - пар, кристалл - пар, кристалл - жидкость и кристалл - кристалл; 4 вида трехфазных равновесий: кристалл - жидкость - пар, кристалл - кристалл - жидкость, кристалл - кристалл - пар и кристалл - кристалл - кристалл; при этом не учитывается возможность образования жидких кристаллов
Фазовые переходы, переходы вещества из одной фазы в другую при изменении параметров состояния, характеризующих термодинамическое равновесие. Значение температуры, давления или какой-либо другой физической величины, при котором происходят фазовые переходы в одно-компонентной системе, называют точкой перехода. При фазовых переходах I рода свойства, выражаемые первыми производными энергии Гиббса G по давлениюр, т-ре Т и другим параметрам, меняются скачком при непрерывном изменении этих параметров. При этом выделяется или поглощается теплота перехода.
Уравнение Клапейрона
— Клаузиуса — термодинамическое уравнение,
относящееся к квазистатическим (равновесным)
процессам перехода вещества
из одной фазы в
другую (испарение, плавление, сублимация,
полиморфное превращение и др.). Согласно
уравнению, теплота фазового перехода
(например, теплота
испарения, теплота
плавления) при квазистатическом
процессе определяется выражением
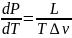 где L—
удельная теплота фазового перехода,
где L—
удельная теплота фазового перехода, 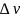 —
изменение удельного объёма тела при
фазовом переходе.
—
изменение удельного объёма тела при
фазовом переходе.
Уравнение названо в честь его авторов, Рудольфа Клаузиуса и Бенуа Клапейрона.
Между температурой
фазового перехода и внешним давлением
существует функциональная связь, причём
при фазовом переходе производная 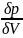 терпит
разрыв. Тогда изотермы для
рассматриваемого вещества будут иметь
характерный вид, изображённый на рисунке.
Для вывода существенен горизонтальный
участок изотермы, соответствующий
фазовому переходу. Слева и справа от
этого участка всё вещество находится
в одной фазе. Осуществим цикл
Карно при бесконечно малой разности
температур следующим образом: сначала
сообщаем телу теплоту, переводя его из
состояния 1 в состояние 2,
затемадиабатически охлаждаем
его на температуру dT, после чего замыкаем
цикл, отводя теплоту и переводя вещество
в фазу 1 с последующим адиабатическим
нагревом. Совершённая работа равна
площади цикла:
терпит
разрыв. Тогда изотермы для
рассматриваемого вещества будут иметь
характерный вид, изображённый на рисунке.
Для вывода существенен горизонтальный
участок изотермы, соответствующий
фазовому переходу. Слева и справа от
этого участка всё вещество находится
в одной фазе. Осуществим цикл
Карно при бесконечно малой разности
температур следующим образом: сначала
сообщаем телу теплоту, переводя его из
состояния 1 в состояние 2,
затемадиабатически охлаждаем
его на температуру dT, после чего замыкаем
цикл, отводя теплоту и переводя вещество
в фазу 1 с последующим адиабатическим
нагревом. Совершённая работа равна
площади цикла:
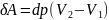
Сообщённая теплота равна

где L— удельная теплота фазового перехода, m — масса тела. Согласно теореме Карно,
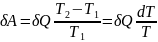
Отсюда
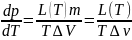
Тройна́я то́чка — точка на фазовой диаграмме, где сходятся три линии фазовых переходов. Тройная точка — это одна из характеристик химического вещества. Обычно тройная точка определяется значением температуры и давления, при котором вещество может равновесно находиться в трёх (отсюда и название) агрегатных состояниях — твёрдом, жидком и газообразном. В этой точке сходятся линии плавления, кипения и сублимации. Критическая точка — сочетание значений температуры Tcrit и давления Pcrit (или, что эквивалентно, молярного объёма Vcrit), при которых исчезает различие в свойствах жидкой и газообразной фаз вещества.
19. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения. Силы поверхностного натяжения. Внутреннее дополнительное давление в жидкости. Явление смачивания.
Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объем системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Сила поверхностного натяжения направлена по касательной к поверхности жидкости, перпендикулярно к участку контура, на который она действует и пропорциональна длине Коэффициентом поверхностного натяжения σ называют физическую величину, численно равную силе поверхностного натяжения, действующей на единичный контур (цепочку молекул единичной длины), находящийся на свободной поверхности жидкости.этого участка.
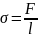 Коэффициент
поверхностного натяжения:
-
уменьшается с повышением температуры;
-
равен нулю в критической точке;
-
зависит от наличия примесей в жидкости.
Коэффициент
поверхностного натяжения:
-
уменьшается с повышением температуры;
-
равен нулю в критической точке;
-
зависит от наличия примесей в жидкости.
Сма́чивание — это поверхностное явление, заключающееся во взаимодействии жидкости с поверхностью твёрдого тела или другой жидкости. Смачивание бывает двух видов:
Иммерсионное (вся поверхность твёрдого тела контактирует с жидкостью)
Контактное (состоит из трёх фаз — твердая, жидкая, газообразная)
Смачивание зависит от соотношения между силами сцепления молекул жидкости с молекулами смачиваемого тела и силами взаимного сцепления молекул жидкости.
Степень смачивания характеризуется углом смачивания. Угол смачивания-это угол, образованный касательными плоскостями к межфазным поверхностям, ограничивающим смачивающую жидкость, а вершина угла лежит на линии раздела трёх фаз. Измеряется методом лежащей капли.
Внутреннее давление вызывает сближение глубинных частиц до тех пор, пока появляющиеся между ними силы отталкивания не уравновесят силы сжатия. Внутреннее давление в жидкостях представляет собой величину порядка десятков тысяч атмосфер; этим объясняется малая сжимаемость жидкостей.
20. Строение твердых тел. Аморфное и кристаллическое состояния. Монокристаллы и поликристаллы. Теплоемкость твердых тел. Внутренняя энергия твердого тела, закон Дюлонга-Пти. Тепловое расширение твердых тел.
Твёрдое тело состоит из миллиарда частиц, которые взаимодействуют между собой.
В твердом состоянии частицы занимают определенное положение относительно друг друга. Вещество обладает низкой сжимаемостью, механической прочностью, поскольку молекулы не имеют свободы движения, а только колебания. Молекулы, атомы или ионы, образующие твердое вещество, называют структурными единицами.
Это обусловливает появление определённого порядка в системе и особых свойств всего количества микрочастиц. Так, коллективные свойства электронов определяют электропроводность твёрдых тел, а способность тела поглощать тепло - теплоёмкость - зависит от характера коллективных колебаний атомов при тепловом движении. Коллективные свойства объясняют все основные закономерности поведения твёрдых тел.
Структура твёрдых тел многообразна. Тем не менее, их можно разделить на два больших класса: кристаллы и аморфные тела.
Кристаллические вещества плавятся при строго определенной температуре Тпл, аморфные – не имеют резко выраженной температуры плавления; при нагревании они размягчаются (характеризуются интервалом размягчения) и переходят в жидкое или вязкотекучее состояние.

Твёрдое тело, состоящее из большого числа маленьких кристалликов, называют монокристаллами.
К поликристаллам относятся не только металлы. Кусок сахара, например, также имеет поликристаллическую структуру.
Большинство кристаллических тел - поликристаллы, так как они состоят из множества сросшихся кристаллов. Одиночные кристаллы - монокристаллы имеют правильную геометрическую форму, и их свойства различны по разным направлениям (анизотропия).
Аморфные тела занимают промежуточное положение между кристаллическими твёрдыми телами и жидкостями. Их атомы или молекулы располагаются в относительном порядке.
Внутренняя энергия тела — это суммарная кинетическая энергия теплового движения его частиц Закон Дюлонга-Пти (Закон постоянства теплоёмкости) — эмпирический закон, согласно которому молярная теплоёмкость твёрдых тел при комнатной температуре близка к 3R:плюс потенциальная энергия их взаимодействия друг с другом.

Закон выводится в предположении, что кристаллическая решетка тела состоит из атомов, каждый из которых совершает гармонические колебания в трех направлениях, определяемыми структурой решетки, причем колебания по различным направлениям абсолютно независимы друг от друга.
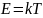
Тепловое расширение — изменение линейных размеров и формы тела при изменении его температуры
Основной закон теплового расширения гласит, что тело с линейным размером L в соответствующем измерении при увеличении его температуры на ΔT расширяется на величину ΔL, равную:
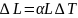 ,
α —
так называемый коэффициент
линейного теплового расширения.
,
α —
так называемый коэффициент
линейного теплового расширения.
