
- •Основные положения теории химического
- •Углеводороды. Классификация.
- •3.Реакции полимеризации
- •1.Реакции присоединения:
- •2.Реакции окисления
- •Реакции полимеризации и сополимеризации олефинов. Натуральный и синтетический каучукипонятие о высокомолекулярных соединениях.
- •1.Реакции замещения
- •2.Реакции присоединения
- •3.Реакции окисления
- •1. Замещение атомов водорода гидроксильных групп
- •2. Замещение гидроксильных групп
- •1.Реакции с участием гидроксильной группы
- •2.Реакции с участием бензольного кольца
- •2.Реакции окисления
- •2.Образование солей:
- •Непредельные одноосновные кислоты. Понятие о двухосновных кислотах и кислотах с несколькими двойными связями.
- •Важнейшие представители: муравьиная, уксусная, капроновая, энантовая, акриловая, щавелевая, олеиновая, стеариновая, сорбиновая кислоты. Реакция поликонденсации.
- •Жиры и масла. Получение, гидролиз и гидрогенизация жиров. Саломас, маргарин.
- •Карбоновые кислоты ароматического ряда. Бензойная кислота. Фталевые кислоты. Понятие об окси-кислотах (молочная, лимонная, винная кислоты).
- •Амины. Классификация, изомерия, номенклатура, получение. Физические и химические свойства (основность, алкилирование, ацилирование, действие азотистой кислоты). Понятие о диаминах.
- •2. Взаимодействие внутри молекулы — образование внутренних солей:
- •3. Взаимодействие аминокислот друг с другом — образование пептидов.
- •3. Цветные (качественные) реакции на белки:
1.Реакции замещения
—Галогенирование
—Нитрование.Реакцию осуществляют смесью концентрированных азотной HN03 и серной H2S04 кислот (нитрующая смесь):
—Сульфирование
—Алкилирование(замещение атома «Н» на алкильную группу) — реакции Фриделя—Крафтеа, образуются гомологи бензола. Вместо галогеналканов можно использовать алкены (в присутствии катализатора — А1С13 или неорганической кислоты).
2.Реакции присоединения
—Гидрирование
—Присоединение хлора
3.Реакции окисления
—Горение
С6Н6 + 15О2→12СО2 + 6Н2О
—Неполное окисление(КМnO4 или К2Сг2O7 в кислойсреде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
1.Впромышленности:
-переработка нефти и угля;
-дегидрированиециклогексана;
-дегидроциклизация(ароматизация) гексана;
-тримеризацияацетилена
2.Влаборатории
Сплавление солей бензойной кислоты с щелочами:
Ароматические соединения, содержащие в своих молекулах несколько бензольных ядер, называют многоядерными. В зависимости от способа соединения этих ядер между собой различают соединения с неконденсированными и конденсированными бензольными ядрами.
Канцерогенные вещества — бластомогенные вещества, канцерогены, карциногены, химические соединения, способные при воздействии на организм вызывать рак. Известно несколько канцерогенных веществ, принадлежащих к разным классам химических соединений. Так, к сильным канцерогенным веществам относятся некоторые полициклические углеводороды с группировкой фенантрена в молекуле, азокрасители, ароматические амины, нитрозамины и др. алкилирующие соединения. К. в. найдены в составе некоторых промышленных продуктов, в воздухе, загрязнённом промышленными выбросами, в табачном дыме и др.
Гетероциклические соединения. Классификация, ароматические и неароматические гетероциклы. Понятие о строении, свойствах и биологической активности гетероциклов (пиррол, тиофен, фуран, пиридин). Понятие о гетероцикле с несколькими гетероатомами (имидазол, пиримидин, пурин) и об алкалоидах (никотин).
Гетероциклические соединения (гетероциклы) — органические соединения, содержащие циклы, в состав которых наряду с углеродом входят и атомы других элементов.
Ароматические гетероциклы представляют собой плоские циклические системы, содержащие вместо одного или нескольких атомов углерода, атомы кислорода, серы, азота.
Среди ароматических гетероциклических соединений наиболее широко распространены и, соответственно, представляют наибольший интерес, пяти- и шести-членные гетероциклы, включающие в своем составе азот, серу и кислород, а также эти же системы, конденсированные с бензольным кольцом. К пятичленным циклическим системам с одним гетероатомом относятся: пиррол, фуран и тиофен:
Пиррол — ароматический пятичленный азотистый гетероцикл, обладает слабыми основными свойствами. Содержится в костном масле (которое получают при сухой перегонке костей), а также в каменноугольной смоле. Пиррольные кольца входят в состав порфиринов — хлорофилла растений, гема гемоглобинов и цитохромов и ряда других биологически важных соединений. Пиррол представляет собой бесцветную жидкость, напоминающую по запаху хлороформ, медленно темнеющую при стоянии на воздухе. Он слегка гигроскопичен, немного растворим в воде и хорошо растворим в большинстве органических растворителей. Химическая формула C4H5N.
Тиофен (тиофуран) — ароматический пятичленный гетероцикл, содержащий один атом серы в цикле, бесцветная жидкость с запахом бензола. Химическая формула C4H4S.
Фуран — органическое соединение с формулой C4H4O. Пятичленный гетероцикл с одним атомом кислорода. Представляет собой бесцветную жидкость с характерным запахом. Родоначальник большой группы органических соединений, многие из которых имеют практическое значение.
Пиридин — шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин — слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения. Химическая формула C5H5N.
Имидазол — органическое соединение класса гетероциклов, пятичленный цикл с двумя атомами азота и тремя атомами углерода в цикле, изомерен пиразолу. Химическая формула C3H4N2
Пиримидин (C4N2H4, 1,3- или м-диазин, миазин) — гетероциклическое соединение, имеющее плоскую молекулу, простейший представитель 1,3-диазинов. Пиримидин — бесцветные кристаллы с характерным запахом.
Пурин (C5N4H4, Purine) — гетероциклическое соединение, простейший представитель имидазо[4,5-d]пиримидинов. Производные пурина играют важную роль в химии природных соединений (пуриновые основания ДНК и РНК; кофермент NAD; алкалоиды, кофеин, теофиллин и теобромин; токсины, сакситоксин и родственные соединения; мочевая кислота) и, благодаря этому, в фармацевтике.
Никотин — алкалоид, содержащийся в растениях семейства паслёновых, преимущественно в табаке и, в меньших количествах, в томатах, картофеле, баклажанах, зелёном перце. Никотиновые алкалоиды также присутствуют в листьях коки. Никотин составляет от 0,3 до 5 % от массы табака в сухом виде, биосинтез никотина происходит в корнях, накапливание никотина — в листьях. Никотин — сильнодействующий нейротоксин и кардиотоксин, особенно действующий на насекомых; вследствие этого никотин раньше широко использовался как инсектицид, а в настоящее время в том же качестве продолжают использоваться производные никотина — такие, как, например, имидаклоприд. формула C10H14N2
Галогенопроизводные, классификация, изомерия и номенклатура. Общая характеристика физических и химических свойств. Промышленное использование галогенопроизводных. Фреоны. Проблема сохранения озонового слоя Земли. Понятие о хлорсодержащих пестицидах.
Галогенопроизводные — соединения, содержащие в составе один или несколько атомов галогена, кроме углерода и водорода. Общая формула ГП: R–Hal, где Hal – F,Cl,Br,J.
Классификация галогенопроизводных:
—Моногалогенопроизводное (Если в составе соединения один галоген, например C2H5Cl)
—Полигалогенопроизводное (Если в составе соединения два и более галогена, например C2H4Cl2,CCl4)
Номенклатура, изомерия
Для галогенпроизводных характерна изомерия положения углеродной цепи и изомерия положения галогена
По рациональной номенклатуре название галогенопроизводных образуют из названия углеводородного радикала и галогена, в необходимых случаях указывают положение последнего.

По систематической номенклатуре положение атома галогена указывают цифрой, которая вместе с его названием располагается перед названием радикала. Нумерацию атомов углерода начинают с того конца молекулы, к которому ближе расположен атом галогена.

Физические свойства
Галогенопроизводные - бесцветные вещества, нерастворимые в воде, но растворимые в большинстве органических растворителей. Алкилгалогениды обладают анестезирующим действием, в больших концентрациях они токсичны. Бензилгалогениды являются слезоточивыми веществами (лакриматорами).
Химические свойства
Галогенопроизводные широко используются в органическом синтезе. В этой связи следует выделить три основные группы реакций: реакции нуклеофильного замещения, реакции элиминирования (отщепления) и реакции с участием металлов.
1.Реакции нуклеофильного замещения атома галогена. Реакции нуклеофильного замещения атома галогена в галогенопроизводных могут быть представлены следующими схемами:
R - X + Y→ R - Y + X или R - X + Y→ R - Y + X
где R — углеводородный остаток; X = F, Cl, Br, I; Y—нуклеофил. Нуклеофилом может быть как анион OH RO RS Hal CN, так и нейтральная молекула, имеющая неподеленнуюэлектронную пару: HOH, ROH, NH3, HHal, RNH2, RSH
Обозначаются реакции нуклеофильного замещения символом SN, где S- замещение и N- нуклеофильное.
По современным представлениям реакции нуклеофильного замещения могут протекать по двум механизмам: мономолекулярному SN1 и бимолекулярному SN2.
Механизм SN2
Этот механизм характерен для первичных алкилгалогенидов.
Реакция замещения происходит в результате постепенного вытеснения старой группы новой группой. Образование новой и разрыв старой связи происходит одновременно.
Механизм SN1
Мономолекулярный механизм характерен для первичных алкилгалогенидов и галогенидов аллильного и бензильного типа.
При мономолекулярном механизме сначала происходит ионизация связи углерод - галоген, а затем нуклеофил быстро взаимодействует с карбкатионом.
Соединения с вторичными радикалами могут реагировать по двум механизмам.
Фреоны — галогеноалканы, фтор- и хлорсодержащие производные насыщенных углеводородов (главным образом метана и этана), используемые как хладагенты в холодильных машинах (например, в кондиционерах). Кроме атомов фтора, в молекулах фреонов содержатся обычно атомы хлора, реже — брома. Известно более 40 различных фреонов; большинство из них выпускается промышленностью. Фреоны — бесцветные газы или жидкости, без запаха. Хорошо растворимы в неполярных органических растворителях, очень плохо — в воде и полярных растворителях. Фреоны очень инертны в химическом отношении, поэтому они не горят на воздухе, невзрывоопасны даже при контакте с открытым пламенем. Однако при нагревании фреонов свыше 250 °C образуются весьма ядовитые продукты, например фосген COCl2, который в годы первой мировой войны использовался как боевое отравляющее вещество. Устойчивы к действию кислот и щелочей.
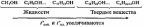 Второй
(после потепления климата) глобальной
экологической проблемой, связанной с
антропогенным загрязнением атмосферы
является истощение озонового слоя
Земли. Доля озона в атмосфере крайне
мала - всего несколько десятимиллионных
долей от объема атмосферы, но он играет
защитную роль, поглощая опасное для
всего живого жесткое ультрафиолетовоеизлучение
Солнца. Озоносфера представляет собой
слой озона в пределах стратосферы (на
высоте 10-50 км), отличающийся повышенным
содержанием озона, причем его максимальная
концентрация наблюдается на высоте
20-25 км, где озона в 10 раз больше, чем у
земной поверхности. Наиболее опасными
для человека последствиями истощения
озонового слоя является увеличение
числа заболеваний раком кожи и катарактой
глаз. Истощение озонового слоя ведет
к усилению парникового эффекта, снижению
урожайности, деградации почв, общему
загрязнению окружающей среды. Основным
антропогенным фактором, разрушающим
озон, в настоящее время считают фреоны
(хладоны). К ним относятся хлорфторуглероды,
широко используемые как газы-носители
(пропилленты) в различного рода
баллончиках, холодильных установках
и т. п. Благодаря своей высокой устойчивости
(живут более 100 лет) фреоны оказались
способными достигать озонового слоя
и высвобождать там атомы хлора. Один
атом хлора как катализатор способен
разрушить до 100 тысяч атомов озона.
Второй
(после потепления климата) глобальной
экологической проблемой, связанной с
антропогенным загрязнением атмосферы
является истощение озонового слоя
Земли. Доля озона в атмосфере крайне
мала - всего несколько десятимиллионных
долей от объема атмосферы, но он играет
защитную роль, поглощая опасное для
всего живого жесткое ультрафиолетовоеизлучение
Солнца. Озоносфера представляет собой
слой озона в пределах стратосферы (на
высоте 10-50 км), отличающийся повышенным
содержанием озона, причем его максимальная
концентрация наблюдается на высоте
20-25 км, где озона в 10 раз больше, чем у
земной поверхности. Наиболее опасными
для человека последствиями истощения
озонового слоя является увеличение
числа заболеваний раком кожи и катарактой
глаз. Истощение озонового слоя ведет
к усилению парникового эффекта, снижению
урожайности, деградации почв, общему
загрязнению окружающей среды. Основным
антропогенным фактором, разрушающим
озон, в настоящее время считают фреоны
(хладоны). К ним относятся хлорфторуглероды,
широко используемые как газы-носители
(пропилленты) в различного рода
баллончиках, холодильных установках
и т. п. Благодаря своей высокой устойчивости
(живут более 100 лет) фреоны оказались
способными достигать озонового слоя
и высвобождать там атомы хлора. Один
атом хлора как катализатор способен
разрушить до 100 тысяч атомов озона.
Спирты, классификация, гомологические ряды одно- и многоатомных спиртов. Изомерия. Номенклатура. Способы получения. Физические свойства. Водородная связь. Химические свойства. Понятие о предельных спиртах и спиртах высшей атомности.
СПИРТЫ (алкоголи) — это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп — ОН у насыщенных атомов углерода. R(OH)m, m≥1
Классификация спиртов по строению УВ радикала:
—Предельные (алканолы)
—Непредельные (алкенолы, алкинолы)
—Ароматические
Классификация спиртов по атомности:
—Одноатомные (олы)
—Многатомные: двухатомные (диолы), трехатомные (триолы)
Предельные одноатомные спирты (алканолы) СnН2n+1ОН, n≥1
Гомологический ряд

Изомерия и номенклатура
По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.
Первые два члена гомологического ряда — СН3ОН и С2Н5ОН — не имеют изомеров, относящихся к классу спиртов. Для остальных алканолов возможны 2 типа изомерии (в пределах своего класса):
— изомерия цепи (углеродного скелета);
— изомерия положения функциональной группы —ОН
Спирты изомерны другому классу соединений — простым эфирам (R-O-R'):
Физические свойства
Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов. Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол и пропанол неограниченно растворяются в воде, с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается, высшие спирты не растворяются в воде.
Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностью(О, N, F, О) другой молекулы. Чем большим положительным зарядом обладает атом водорода и чем больше способность другого атома отдавать свои не поделенные электронные пары, тем легче образуется водородная связьи тем она прочнее.
Химические свойства
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей О—Н, С—О, С—Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
1. Реакции замещения
—Замещение атома водорода гидроксильной группы вследствие разрыва связи 0—Н.
а) Взаимодействие с активными металлами с образованием алкоголятов (алканолятов) металлов. Эти реакции протекают только в безводной среде; в присутствии воды алкоголяты полностью гидролизуются.
б) Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакции этерификации). Реакции этерификации являются обратимыми реакциями.
—Замещение гидроксильной группы вследствие разрыва связи С—О.
а) Взаимодействие с галогеноводородами с образованием галогеналканов.
б) Взаимодействие с аммиаком с образованием аминов.
2. Реакции отщепления
—Дегидратация, т. е. отщепление воды.
Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—О—R'. Эти реакции могут протекать сучастием одного спирта или смеси двух и более спиртов.
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта.
—Дегидрирование (разрыв связей О—Н и С—Н)
а) При дегидрировании первичных спиртов образуются альдегиды;
б) При дегидрировании вторичных спиртов образуются кетоны.
в) Третичные спирты не дегидрируются.
3.Реакции окисления
—Горение (полное окисление).Спирты горят на воздухе с выделением большого количества тепла (на этом основано использование спиртовок).
—Неполное окислениепод действием окислителей: кислорода воздуха в присутствии катализаторов. Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования.
Предельные многоатомные спирты
Свойства многоатомных спиртов рассмотрим на примере простейшего трехатомного спирта — глицерина, или пропантриола-1,2,3
Физические свойства
Глицерин — вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с Гкип = 290DC. Смешивается с водой во всех отношениях.
Химические свойства
