
- •Аминокислоты Аминокислотный состав белков
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Н езаменимые аминокислоты
- •Пищевая ценность белков
- •Биологические функции белков
- •Структурная организация белковых молекул
- •Классификация белков по растворимости
- •Физико-химические свойства белков
- •Первичная структура белков
- •Конформация пептидных цепей в белках
- •Третичная структура белков
- •Силы, стабилизирующие третичную структуру белка.
- •Четвертичная структура белка.
- •Ферменты
- •Особенности ферментов как биокатализаторов
- •Классификация ферментов по типу катализируемой реакции и номенклатура ферментов
- •Активный центр ферментов
- •Причины высокой каталитической активности.
- •Субстратная специфичность
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Влияние активаторов и ингибиторов на активность ферментов
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Единицы ферментативной активности ферментов
- •Регуляция ферментативной активности
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •Углеводы Общая характеристика и классификация.
- •Моносахариды
- •Цикло-оксо-таутомерия
- •Химические свойства
- •Дисахариды
- •Полисахариды
- •Классификация и основные структурные компоненты омыляемых липидов.
- •Высшие жирные кислоты – это карбоновые кислоты, насыщенные или ненасыщенные, выделенные из жиров путем гидролиза. Для их строения характерны следующие основные особенности:
- •Нейтральные липиды
- •Триацилглицериды
- •Неомыляемые липиды
- •Витамины
- •Водорастворимые витамины Тиамин (витамин в1)
- •Рибофлавин (витамин в2)
- •Ниацин (никотинамид, никотиновая кислота, витамин рр)
- •Пантотеновая кислота
- •Пиридоксин (пиридоксаль, пиридоксамин, витамин в6)
- •Биотин (витамин н)
- •Фолиевая кислота
- •Витамин в12
- •Аскорбиновая кислота (витамин с)
- •Жирорастворимые витамины Витамин а
- •Биохимические функции витамина а Регуляция экспрессии генов
- •Витамин а и акт зрения
- •Гипервитаминоз и гиповитаминоз
- •Витамин д (кальциферол)
- •Витамин е (токоферолы)
- •Витамин к (нафтохиноны)
- •Биоэнергетика. Основные понятия и определения Особенности живых организмов как объектов для термодинамических исследований
- •Сопряжение экзергонических процессов с эндергоническими
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Клеточное дыхание
- •Биосинтез вжк в тканях
- •Гниение аминокислот, обезвреживание продуктов гниения
- •Метаболизм аминокислот
- •Пути обезвреживания аммиака
- •Глюконеогенез
Причины высокой каталитической активности.
Фермент поддерживает микроокружение субстрата в активном центре в состоянии отличном от его состояния в водной среде. Располагает реагирующие атомы в правильной ориентации и на необходимом расстоянии друг от друга, чтобы обеспечить оптимальное протекание реакции. За счет кооперативного взаимодействия субстрата и нескольких остатков аминокислот в активном центре фермент снижает энергию активации данной реакции.
Субстратная специфичность
Структура активного центра фермента комплементарна структуре субстрата, т.е. соответствует ему по 1) форме, 2) размерам и 3) способности взаимодействовать. Это является причинами высокой специфичности ферментов. Первоначально модель активного центра, предложенная Э.Фишером, трактовала взаимодействие субстрата и фермента по аналогии с системой «ключ-замок» – модель «жесткой матрицы». Однако эта модель объясняла лишь абсолютную субстратную специфичность.
Кошланд предложил модель индуцированного соответствия. Главная черта этой модели – гибкость каталитического центра. В модели Фишера каталитический центр считается заранее подготовленным под форму молекулы-субстрата. В модели Кошланда субстрат индуцирует конформационные изменения фермента, и лишь в результате этих аминокислотные остатки и другие группы фермента принимают пространственную ориентацию, необходимую для связи с субстратом и катализа. Эта модель позволяет объяснить относительную специфичность фермента.
Каждый фермент катализирует не любые из всех возможных путей превращения субстрата, а какое-либо одно. Это свойство называется специфичностью пути превращения.
Кинетика ферментативных реакций
Зависимость скорости ферментативной реакции от концентрации субстрата. Уравнение Михаэлиса-Ментен.Любую ферментативную реакцию схематично можно описать следующим образом:
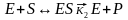
Поведение многих ферментов при изменении концентрации субстрата описывает уравнение Михаэлиса-Ментен:
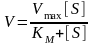 ,
где
,
где
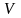 -
скорость ферментативной реакции,
-
скорость ферментативной реакции,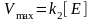 -
максимальная скорость ферментативной
реакции при полном насыщении фермента
субстратом,
-
максимальная скорость ферментативной
реакции при полном насыщении фермента
субстратом,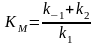 – константа Михаэлиса,
– константа Михаэлиса,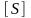 –
концентрация субстрата.
–
концентрация субстрата.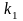 -
константа образования фермент-субстратного
комплекса ES,
-
константа образования фермент-субстратного
комплекса ES,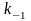 -
константа диссоциации фермент-субстратного
комплекса ES.
-
константа диссоциации фермент-субстратного
комплекса ES.
В лияние
концентрации субстрата на скорость
ферментативной реакции, описываемое
этим уравнением, можно изобразить
графически:
лияние
концентрации субстрата на скорость
ферментативной реакции, описываемое
этим уравнением, можно изобразить
графически:
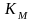 равна
концентрации субстрата при скорости
ферментативной реакции, равной половине
максимальной скорости и характеризует
сродство данного фермента к тому или
иному субстрату. Некоторые ферменты
требуют высокой концентрации субстрата
для достижения скорости, равной
максимальной, другие (например,
гексокиназа) достигают
равна
концентрации субстрата при скорости
ферментативной реакции, равной половине
максимальной скорости и характеризует
сродство данного фермента к тому или
иному субстрату. Некоторые ферменты
требуют высокой концентрации субстрата
для достижения скорости, равной
максимальной, другие (например,
гексокиназа) достигают
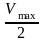 при очень низкой концентрации субстрата.
при очень низкой концентрации субстрата.
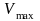 - скорость реакции при 250С,
оптимальном значении рН, полном насыщении
фермента субстратом.
- скорость реакции при 250С,
оптимальном значении рН, полном насыщении
фермента субстратом.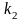 -
число оборотов
фермента,
т.е. число молекул субстрата, которое
превращает одна молекула фермента за
1 минуту.
-
число оборотов
фермента,
т.е. число молекул субстрата, которое
превращает одна молекула фермента за
1 минуту.
Например:
карбоксиангидраза 36000000
-амилаза 1100000
фосфоглюкомутаза 1240
