
- •Аминокислоты Аминокислотный состав белков
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Н езаменимые аминокислоты
- •Пищевая ценность белков
- •Биологические функции белков
- •Структурная организация белковых молекул
- •Классификация белков по растворимости
- •Физико-химические свойства белков
- •Первичная структура белков
- •Конформация пептидных цепей в белках
- •Третичная структура белков
- •Силы, стабилизирующие третичную структуру белка.
- •Четвертичная структура белка.
- •Ферменты
- •Особенности ферментов как биокатализаторов
- •Классификация ферментов по типу катализируемой реакции и номенклатура ферментов
- •Активный центр ферментов
- •Причины высокой каталитической активности.
- •Субстратная специфичность
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Влияние активаторов и ингибиторов на активность ферментов
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Единицы ферментативной активности ферментов
- •Регуляция ферментативной активности
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •Углеводы Общая характеристика и классификация.
- •Моносахариды
- •Цикло-оксо-таутомерия
- •Химические свойства
- •Дисахариды
- •Полисахариды
- •Классификация и основные структурные компоненты омыляемых липидов.
- •Высшие жирные кислоты – это карбоновые кислоты, насыщенные или ненасыщенные, выделенные из жиров путем гидролиза. Для их строения характерны следующие основные особенности:
- •Нейтральные липиды
- •Триацилглицериды
- •Неомыляемые липиды
- •Витамины
- •Водорастворимые витамины Тиамин (витамин в1)
- •Рибофлавин (витамин в2)
- •Ниацин (никотинамид, никотиновая кислота, витамин рр)
- •Пантотеновая кислота
- •Пиридоксин (пиридоксаль, пиридоксамин, витамин в6)
- •Биотин (витамин н)
- •Фолиевая кислота
- •Витамин в12
- •Аскорбиновая кислота (витамин с)
- •Жирорастворимые витамины Витамин а
- •Биохимические функции витамина а Регуляция экспрессии генов
- •Витамин а и акт зрения
- •Гипервитаминоз и гиповитаминоз
- •Витамин д (кальциферол)
- •Витамин е (токоферолы)
- •Витамин к (нафтохиноны)
- •Биоэнергетика. Основные понятия и определения Особенности живых организмов как объектов для термодинамических исследований
- •Сопряжение экзергонических процессов с эндергоническими
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Клеточное дыхание
- •Биосинтез вжк в тканях
- •Гниение аминокислот, обезвреживание продуктов гниения
- •Метаболизм аминокислот
- •Пути обезвреживания аммиака
- •Глюконеогенез
Зависимость скорости ферментативной реакции от температуры
В
пределах физиологических условий
зависимость скорости реакции от
температуры подчиняется законам
химической кинетики, т.е. описывается
уравнением Аррениуса. Так при увеличении
температуры тела с 360С
до 390С
скорость биохимических процессов в
организме увеличивается в 1,2 – 1,4 раза.
В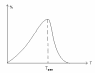 ыше
определенной температуры начинается
тепловая денатурация белковых молекул,
в том числе и ферментов, которые при
этом теряют свою биологическую
активность.
ыше
определенной температуры начинается
тепловая денатурация белковых молекул,
в том числе и ферментов, которые при
этом теряют свою биологическую
активность.
Процесс денатурации белков играет большую роль в технологии пищевых продуктов при их тепловой обработке. При выпечке хлебобулочных изделий примерно при 60-700С белки теста (клейковина) денатурируют; этот процесс имеет большое значение при формировании мякиша изделия. Обработка свекловичной стружки водой при температуре 70-800С, осуществляемая при получении диффузионного сока, вызывает денатурацию белков мембран и протоплазмы клеток свекловичной стружки и резко повышает скорость диффузии сахарозы из нее. Бланшировка плодов и овощей перед их консервированием вызывает денатурацию (инактивацию) окислительно-восстановительных ферментов, ведет к сохранению витамина С. Тепловая обработка пищевых продуктов повышает их вкусовые качества, биологическую ценность, так как денатурированные белки легче подвергаются атаке пищеварительных ферментов.
Зависимость скорости ферментативной реакции от рН
Большинство ферментов характерным образом изменяют свою активность в зависимости от рН. Оптимальной активности соответствует определенная область рН, причем уменьшение и увеличение рН приводит к снижению активности. Для различных реакций значения оптимума рН колеблются в широких пределах от сильно кислой среды (например, для пепсина) до сильно щелочной (например, для щелочной фосфотазы). Поэтому для работы с ферментами необходимо поддерживать рН с помощью соответствующего буфера. Зависимость ферментативной активности от рН определяется значением рК ионогенных групп белковой молекулы, особенно тех, которые находятся в активном центре молекулы или вблизи него (и, возможно, играют роль в связывании кофермента), а также групп, ответственных за изменение состояния активного центра путем конформационных изменений белковой молекулы. Кроме того, рН может влиять на степень ионизации или пространственную организацию субстрата.
Влияние активаторов и ингибиторов на активность ферментов
Активаторы - это молекулы или ионы, которые увеличивают активность ферментов. Часто в качестве активаторов выступают ионы металлов (Mn2+, Mg2+, Zn2+, Co2+, K+) и хлорид-ион (Cl-). Механизм активации ферментов под действием этих ионов может быть разным:
ионы являются коферментами и входят в состав активного центра;
облегчают образование ES;
облегчают присоединение кофермента к апоферменту;
обеспечивают образование устойчивой четвертичной структуры белков.
Ингибиторы - это молекулы или ионы, снижающие активность ферментов.
Различают два больших класса ингибиторов ферментативной активности - на основании того, ослабляется (конкурентное ингибирование) или не ослабляется (неконкурентное ингибирование) их ингибирующее действие при повышении концентрации субстрата.
Другой способ классификации ингибиторов основывается на характере места их связывания с ферментом в том же месте, что и субстрат (в активном центре), а другие - на значительном расстоянии от активного центра.
