
- •Аминокислоты Аминокислотный состав белков
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Н езаменимые аминокислоты
- •Пищевая ценность белков
- •Биологические функции белков
- •Структурная организация белковых молекул
- •Классификация белков по растворимости
- •Физико-химические свойства белков
- •Первичная структура белков
- •Конформация пептидных цепей в белках
- •Третичная структура белков
- •Силы, стабилизирующие третичную структуру белка.
- •Четвертичная структура белка.
- •Ферменты
- •Особенности ферментов как биокатализаторов
- •Классификация ферментов по типу катализируемой реакции и номенклатура ферментов
- •Активный центр ферментов
- •Причины высокой каталитической активности.
- •Субстратная специфичность
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Влияние активаторов и ингибиторов на активность ферментов
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Единицы ферментативной активности ферментов
- •Регуляция ферментативной активности
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •Углеводы Общая характеристика и классификация.
- •Моносахариды
- •Цикло-оксо-таутомерия
- •Химические свойства
- •Дисахариды
- •Полисахариды
- •Классификация и основные структурные компоненты омыляемых липидов.
- •Высшие жирные кислоты – это карбоновые кислоты, насыщенные или ненасыщенные, выделенные из жиров путем гидролиза. Для их строения характерны следующие основные особенности:
- •Нейтральные липиды
- •Триацилглицериды
- •Неомыляемые липиды
- •Витамины
- •Водорастворимые витамины Тиамин (витамин в1)
- •Рибофлавин (витамин в2)
- •Ниацин (никотинамид, никотиновая кислота, витамин рр)
- •Пантотеновая кислота
- •Пиридоксин (пиридоксаль, пиридоксамин, витамин в6)
- •Биотин (витамин н)
- •Фолиевая кислота
- •Витамин в12
- •Аскорбиновая кислота (витамин с)
- •Жирорастворимые витамины Витамин а
- •Биохимические функции витамина а Регуляция экспрессии генов
- •Витамин а и акт зрения
- •Гипервитаминоз и гиповитаминоз
- •Витамин д (кальциферол)
- •Витамин е (токоферолы)
- •Витамин к (нафтохиноны)
- •Биоэнергетика. Основные понятия и определения Особенности живых организмов как объектов для термодинамических исследований
- •Сопряжение экзергонических процессов с эндергоническими
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Клеточное дыхание
- •Биосинтез вжк в тканях
- •Гниение аминокислот, обезвреживание продуктов гниения
- •Метаболизм аминокислот
- •Пути обезвреживания аммиака
- •Глюконеогенез
Аминокислоты Аминокислотный состав белков
Ключ к пониманию структуры любого белка дает небольшая группа довольно простых молекул - -аминокислот, играющих роль строительных блоков. Для построения всех белков используется один и тот же набор 20 различных, ковалентно связанных друг с другом в определенной, характерной только для данного белка последовательности. Каждая аминокислота благодаря особенностям ее боковой цепи наделена химической индивидуальностью, поэтому всю группу 20 аминокислот можно рассматривать как алфавит "языка" белковой структуры.
Строение и классификация аминокислот
Все 20 аминокислот, встречающихся в белках, характеризуются общей структурной особенностью - наличием карбоксильной и аминогруппы, связанных с одним и тем же атомом углерода. Различаются же аминокислоты боковыми цепями (R-группами).
Ф![]() ормулы
и тривиальные названия важнейших
аминокислот приведены в таблице. Для
биологического функционирования
аминокислот в составе белков определяющим
является полярность радикала R.
По этому признаку аминокислоты разделяют
на следующие основные группы.
ормулы
и тривиальные названия важнейших
аминокислот приведены в таблице. Для
биологического функционирования
аминокислот в составе белков определяющим
является полярность радикала R.
По этому признаку аминокислоты разделяют
на следующие основные группы.
Аминокислоты, содержащие неполярный радикал R. Такие группы располагаются внутри молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
Аминокислоты, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отрицательно запряженных групп. Такие аминокислоты содержат в боковом радикале дополнительный основный или кислотный центр, который в водном растворе может соответственно присоединять или отдавать протон.
В белках ионогенные группы этих аминокислот
располагаются, как правило, на поверхности
молекулы и обуславливают электростатические
взаимодействия.
белках ионогенные группы этих аминокислот
располагаются, как правило, на поверхности
молекулы и обуславливают электростатические
взаимодействия.
Стереоизомерия.
Все
стандартные аминокислоты содержат
ассиметрический
атом углерода
в -положении,
т.е. атом углерода с четырьмя различными
заместителями. Такой атом углерода
является хиральным
центром.
Благодаря тому, что связи вокруг -атома
углерода имеют тераэдрическое
расположение, четыре различных
заместителя могут располагаться в
пространстве двумя различными способами,
так что молекула может существовать в
двух конфигурациях, представляющих
собой несовместимые зеркальные
отображения. Т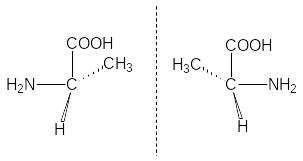 аким
образом, соединения с хиральным центром
встречаются в двух изомерных формах,
у которых одинаковые физические и
химические свойства, за исключением
одного - способности вращать плоскость
плоскополяризованного луча света в
разные стороны на определенный угол.
Эти соединения обладают оптической
активностью.
В основе строгой системы классификации
и обозначения стереоизомеров лежит не
вращение плоскости поляризации света,
а абсолютная конфигурация молекулы
стереоизомера, т.е. взаимное расположение
четырех заместителей. Для выяснения
конфигурации оптически активных
соединений их сравнивают с каким-нибудь
одним соединением, выбранным в качестве
эталона, например, глицеральдегидом.
аким
образом, соединения с хиральным центром
встречаются в двух изомерных формах,
у которых одинаковые физические и
химические свойства, за исключением
одного - способности вращать плоскость
плоскополяризованного луча света в
разные стороны на определенный угол.
Эти соединения обладают оптической
активностью.
В основе строгой системы классификации
и обозначения стереоизомеров лежит не
вращение плоскости поляризации света,
а абсолютная конфигурация молекулы
стереоизомера, т.е. взаимное расположение
четырех заместителей. Для выяснения
конфигурации оптически активных
соединений их сравнивают с каким-нибудь
одним соединением, выбранным в качестве
эталона, например, глицеральдегидом.
П![]()
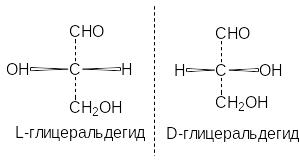 очти
все природные биологически активные
соединения, содержащие хиральный центр,
встречаются только в какой-нибудь
одной стереоизомерной форме - D
или L.
Все аминокислоты, входящие в состав
белков, являются L-изомерами.
Живые клетки обладают уникальной
способностью синтезировать L-аминокислоты
с помощью стереоспецифичных ферментов.
Стереоспецифичность этих ферментов
обусловлена ассимитрическим характером
их активных центров.
очти
все природные биологически активные
соединения, содержащие хиральный центр,
встречаются только в какой-нибудь
одной стереоизомерной форме - D
или L.
Все аминокислоты, входящие в состав
белков, являются L-изомерами.
Живые клетки обладают уникальной
способностью синтезировать L-аминокислоты
с помощью стереоспецифичных ферментов.
Стереоспецифичность этих ферментов
обусловлена ассимитрическим характером
их активных центров.
