
- •Аминокислоты Аминокислотный состав белков
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Н езаменимые аминокислоты
- •Пищевая ценность белков
- •Биологические функции белков
- •Структурная организация белковых молекул
- •Классификация белков по растворимости
- •Физико-химические свойства белков
- •Первичная структура белков
- •Конформация пептидных цепей в белках
- •Третичная структура белков
- •Силы, стабилизирующие третичную структуру белка.
- •Четвертичная структура белка.
- •Ферменты
- •Особенности ферментов как биокатализаторов
- •Классификация ферментов по типу катализируемой реакции и номенклатура ферментов
- •Активный центр ферментов
- •Причины высокой каталитической активности.
- •Субстратная специфичность
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Влияние активаторов и ингибиторов на активность ферментов
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Единицы ферментативной активности ферментов
- •Регуляция ферментативной активности
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •Углеводы Общая характеристика и классификация.
- •Моносахариды
- •Цикло-оксо-таутомерия
- •Химические свойства
- •Дисахариды
- •Полисахариды
- •Классификация и основные структурные компоненты омыляемых липидов.
- •Высшие жирные кислоты – это карбоновые кислоты, насыщенные или ненасыщенные, выделенные из жиров путем гидролиза. Для их строения характерны следующие основные особенности:
- •Нейтральные липиды
- •Триацилглицериды
- •Неомыляемые липиды
- •Витамины
- •Водорастворимые витамины Тиамин (витамин в1)
- •Рибофлавин (витамин в2)
- •Ниацин (никотинамид, никотиновая кислота, витамин рр)
- •Пантотеновая кислота
- •Пиридоксин (пиридоксаль, пиридоксамин, витамин в6)
- •Биотин (витамин н)
- •Фолиевая кислота
- •Витамин в12
- •Аскорбиновая кислота (витамин с)
- •Жирорастворимые витамины Витамин а
- •Биохимические функции витамина а Регуляция экспрессии генов
- •Витамин а и акт зрения
- •Гипервитаминоз и гиповитаминоз
- •Витамин д (кальциферол)
- •Витамин е (токоферолы)
- •Витамин к (нафтохиноны)
- •Биоэнергетика. Основные понятия и определения Особенности живых организмов как объектов для термодинамических исследований
- •Сопряжение экзергонических процессов с эндергоническими
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Клеточное дыхание
- •Биосинтез вжк в тканях
- •Гниение аминокислот, обезвреживание продуктов гниения
- •Метаболизм аминокислот
- •Пути обезвреживания аммиака
- •Глюконеогенез
Обратимое конкурентное ингибирование аналогами субстрата
Химическая структура ингибитора (I) сходна со структурой субстрата, поэтому связывание ингибитора с ферментом происходит в активном центре фермента с образованием комплекса E-I. Этот комплекс может диссоциировать. Когда в реакционной смеси одновременно присутствуют и субстрат, и ингибитор, то они конкурируют за один и тот же связывающий центр. При увеличении концентрации субстрата происходит вытеснение ингибитора из активного центра фермента. Таким образом, максимальная скорость ферментативной реакции в этом случае не меняется, а константа Михаэлиса (Км) уменьшается.
Обратимое неконкурентное ингибирование
В этом случае конкуренция между субстратом и ингибитором отсутствует. При этом ингибитор ничем не напоминает субстрат и связывается не с активным центром фермента. Обратимые неконкурентные ингибиторы понижают максимальную скорость, но не влияют на KM.
Необратимое ингибирование
Ф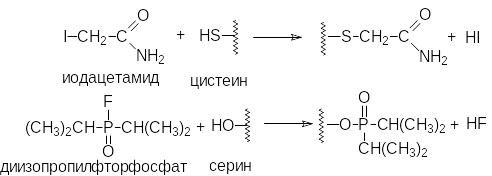 ерментативная
активность может уменьшаться в
присутствии многих "ядов", таких
как иодацетамид, диизопропилфторфосфат
(нервно-паралитический яд), ионы тяжелых
металлов (Ag+,
Hg2+),
окисляющие агенты и т.д. Многие инсектициды
действуют по такому механизму.
ерментативная
активность может уменьшаться в
присутствии многих "ядов", таких
как иодацетамид, диизопропилфторфосфат
(нервно-паралитический яд), ионы тяжелых
металлов (Ag+,
Hg2+),
окисляющие агенты и т.д. Многие инсектициды
действуют по такому механизму.
Единицы ферментативной активности ферментов
Ферменты обнаруживают по превращению их субстратов, а количественно измеряют по величине каталитической активности, т.е. по скорости реакции, проходящей при участии фермента. Для этого измеряют начальную скорость реакции, когда она линейно зависит от концентрации фермента. За единицу активности (Е) фермента принимают такое его количество, которое катализирует превращение 1 мкмоль субстрата за 1 мин (международная единица активности фермента - 1 катал = 1моль/1c). Концентрацию фермента в растворе выражают в единицах на 1 мл (Е/мл) (международная единица - катал/л). Часто бывает необходимо выражать активность не в расчете на объем раствора, а в расчете на содержание белка. Удельная активность выражается в единицах фермента на 1 мг белка (Е/мг) (международная единица -катал/г). Для сопоставления каталитической эффективности разных ферментов определяют молекулярную активность, которая соответствует числу единиц в 1 мкмоль фермента (Е/мкмоль) или соответствует числу молекул субстрата, превращаемых 1 молекулой фермента за 1 мин. Молекулярную активность можно определить лишь в том случае, если известны молекулярная масса фермента и его молекулярная концентрация в растворе.
Регуляция ферментативной активности
Для нормального функционирования организма должна осуществляться точная регуляция потока метаболитов по анаболическим и катаболическим путям. Все биохимические процессы должны быть скоординированы и должны отвечать на изменения во внешней среде (например, на поступление питательных веществ), а также на периодически происходящие внутриклеточные события (например, репликацию ДНК). Поток веществ, проходящий через ту или иную реакцию, можно регулировать, изменяя следующие параметры: 1) абсолютное количество присутствующего фермента; 2) каталитическую эффективность фермента.
Регуляция количества фермента путем регуляции скорости его синтеза и распада
Синтез и распад ферментов, как и других белков, происходит в организме непрерывно. У взрослого здорового человека в условиях динамического равновесия процессы синтеза и распада имеют одинаковую скорость, благодаря чему общее содержание ферментов не изменяется во времени. Однако, для адаптации к изменениям внешней среды или в ответ на внутриклеточные изменения, смещается равновесие между процессами синтеза и распада ферментов. У всех живых организмов синтез ферментов (из аминокислот) и распад (до аминокислот) представляют собой разные процессы, которые катализируются разными ферментами. В этих условиях легко осуществляется независимая регуляция скорости синтеза фермента и скорости его распада. Клетки могут синтезировать специфические ферменты в ответ на присутствие специфических низкомолекулярных индукторов, т.е. веществ, которые могут влиять на скорость синтеза фермента и оказывать существенное воздействие на регуляцию обмена веществ путем соотношения ферментов в организме. Ферменты, концентрация которых всегда постоянна и не зависит от условий, называются конститутивными. Ферменты, концентрация которых может меняться, называются адаптивными.
