
- •Аминокислоты Аминокислотный состав белков
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Н езаменимые аминокислоты
- •Пищевая ценность белков
- •Биологические функции белков
- •Структурная организация белковых молекул
- •Классификация белков по растворимости
- •Физико-химические свойства белков
- •Первичная структура белков
- •Конформация пептидных цепей в белках
- •Третичная структура белков
- •Силы, стабилизирующие третичную структуру белка.
- •Четвертичная структура белка.
- •Ферменты
- •Особенности ферментов как биокатализаторов
- •Классификация ферментов по типу катализируемой реакции и номенклатура ферментов
- •Активный центр ферментов
- •Причины высокой каталитической активности.
- •Субстратная специфичность
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Влияние активаторов и ингибиторов на активность ферментов
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Единицы ферментативной активности ферментов
- •Регуляция ферментативной активности
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •Углеводы Общая характеристика и классификация.
- •Моносахариды
- •Цикло-оксо-таутомерия
- •Химические свойства
- •Дисахариды
- •Полисахариды
- •Классификация и основные структурные компоненты омыляемых липидов.
- •Высшие жирные кислоты – это карбоновые кислоты, насыщенные или ненасыщенные, выделенные из жиров путем гидролиза. Для их строения характерны следующие основные особенности:
- •Нейтральные липиды
- •Триацилглицериды
- •Неомыляемые липиды
- •Витамины
- •Водорастворимые витамины Тиамин (витамин в1)
- •Рибофлавин (витамин в2)
- •Ниацин (никотинамид, никотиновая кислота, витамин рр)
- •Пантотеновая кислота
- •Пиридоксин (пиридоксаль, пиридоксамин, витамин в6)
- •Биотин (витамин н)
- •Фолиевая кислота
- •Витамин в12
- •Аскорбиновая кислота (витамин с)
- •Жирорастворимые витамины Витамин а
- •Биохимические функции витамина а Регуляция экспрессии генов
- •Витамин а и акт зрения
- •Гипервитаминоз и гиповитаминоз
- •Витамин д (кальциферол)
- •Витамин е (токоферолы)
- •Витамин к (нафтохиноны)
- •Биоэнергетика. Основные понятия и определения Особенности живых организмов как объектов для термодинамических исследований
- •Сопряжение экзергонических процессов с эндергоническими
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Клеточное дыхание
- •Биосинтез вжк в тканях
- •Гниение аминокислот, обезвреживание продуктов гниения
- •Метаболизм аминокислот
- •Пути обезвреживания аммиака
- •Глюконеогенез
Витамин к (нафтохиноны)
Витамин К1 содержится в зеленых растениях (капусте, шпинате), фруктах, корнеплодах.
Витамин К2 синтезируется бактериями кишечника. В настоящее время производятся водорастворимые синтетические аналоги витамина К – викасол, менадион, синкавит. Суточная потребность 2 мг.
Витамин К является компонентом карбоксилирующего фермента. Он участвует в поддержании нормальных уровней факторов свертывания крови: II, VII, IX, X, синтезирующихся в печени в виде неактивных предшественников.
Активация заключается в -карбоксилировании глутамата этих предшественников под действием микросомальной карбоксилазы, котрая нуждаетсяв витамине К как кофакторе. Например, при карбоксилировании протромбина образуется белок, который является эффективным лигандом для ионов кальция за счет образования дополнительных карбоксильных групп. После хелатирования ионов кальция протромбин связывается с фосфолипидами мембран и подвергается ограниченному протеолизу под действием активированного фактора-X с образованием тромбина, который запускает каскадную систему свертывания крови с образованием фибринового сгустка. Недостаточность витамина К наблюдается крайне редко, так как этот витамин синтезируется кишечными бактериями.
Биоэнергетика. Основные понятия и определения Особенности живых организмов как объектов для термодинамических исследований
Химическая термодинамика является теоретической основой биоэнергетики. Биоэнергетика занимается изучением энергетических превращений, сопровождающих биохимические реакции. Все эти превращения осуществляются в полном соответствии с первым и вторым началами термодинамики.
Сопряжение экзергонических процессов с эндергоническими
Человек получает энергию за счет разложения органических веществ пищи. Органические вещества являются термодинамически нестабильными. Катаболические превращения этих веществ (распад или окисление) протекают с уменьшением свободной энергии. Такие процессы являются самопроизвольными (экзергоническими -G<0) и могут служить источником энергии для функционирования живой клетки. Все процессы, которые идут с увеличением свободной энергии (эндергонические -G>0), несамопроизвольные и должны быть сопряжены с экзергоническими процессами.
Ж изненно
важные процессы - реакции синтеза (т.е.
анаболические
процессы),
мышечное сокращение, активный транспорт
- являются эндергоническими процессами.
Эндергонический процесс не может
протекать изолированно. Такие процессы
получают энергию путем химического
сопряжения
с реакциями окисления молекул пищевых
веществ (катаболическими
процессами),
которые являются экзергоническими
реакциями. Совокупность метаболических
и анаболических процессов есть
метаболизм.
изненно
важные процессы - реакции синтеза (т.е.
анаболические
процессы),
мышечное сокращение, активный транспорт
- являются эндергоническими процессами.
Эндергонический процесс не может
протекать изолированно. Такие процессы
получают энергию путем химического
сопряжения
с реакциями окисления молекул пищевых
веществ (катаболическими
процессами),
которые являются экзергоническими
реакциями. Совокупность метаболических
и анаболических процессов есть
метаболизм.
С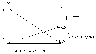 хематически
такое сопряжение можно проиллюстрировать
следующим образом. Пусть превращение
метаболита (промежуточного соединения
в цепи реакций) А
в метаболит В
сопровождается выделением свободной
энергии. Оно сопряжено с другой реакцией
- превращением метаболита С
в метаболит
D,
которое может происходить лишь при
поступлении свободной энергии. Каким
же образом осуществляется это сопряжение?
Одним из возможных механизмов состоит
в образовании промежуточного соединения
- общего для обеих реакций.
хематически
такое сопряжение можно проиллюстрировать
следующим образом. Пусть превращение
метаболита (промежуточного соединения
в цепи реакций) А
в метаболит В
сопровождается выделением свободной
энергии. Оно сопряжено с другой реакцией
- превращением метаболита С
в метаболит
D,
которое может происходить лишь при
поступлении свободной энергии. Каким
же образом осуществляется это сопряжение?
Одним из возможных механизмов состоит
в образовании промежуточного соединения
- общего для обеих реакций.
A + C I B + D
З![]()
 десь
заложен механизм регуляции скорости
окислительных процессов, т.к. скорость
потребления D
определяет скорость окисления А.
Этим путем осуществляется дыхательный
контроль - процесс,
позволяющий организму избежать
неконтролируемого самоокисления.
Другим примером сопряжения являются
дегидрогеназные реакции (реакции
отщепления атомов водорода), промежуточным
соединением, в которых является
промежуточный переносчик атомов
водорода. Еще один пример сопряжения
состоит в синтезе в ходе экзергонических
реакций высокоэнергетического
соединения, общего для многих процессов,
и последующего включения этого соединения
в эндергонические реакции, что
обеспечивает передачу энергии. Таким
общим для многих реакций соединением
- энергетической валютой клетки -
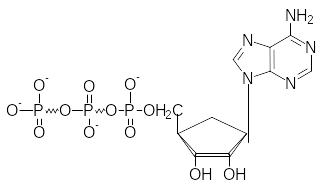
является аденозинтрифосфат (АТР).
десь
заложен механизм регуляции скорости
окислительных процессов, т.к. скорость
потребления D
определяет скорость окисления А.
Этим путем осуществляется дыхательный
контроль - процесс,
позволяющий организму избежать
неконтролируемого самоокисления.
Другим примером сопряжения являются
дегидрогеназные реакции (реакции
отщепления атомов водорода), промежуточным
соединением, в которых является
промежуточный переносчик атомов
водорода. Еще один пример сопряжения
состоит в синтезе в ходе экзергонических
реакций высокоэнергетического
соединения, общего для многих процессов,
и последующего включения этого соединения
в эндергонические реакции, что
обеспечивает передачу энергии. Таким
общим для многих реакций соединением
- энергетической валютой клетки -
является аденозинтрифосфат (АТР).
Это позволяет сопрягать большее число экзергонических реакций с большим числом эндергонических. В молекуле АТР две макроэргические связи, т.е. связи, при гидролизе которых высвобождается энергия.
