
- •Предмет, содержание и задачи «Неорганической химии»
- •Химия как наука естествознания. Основная проблема химии и общие способы её решения.
- •Химия и переработка продуктов общественного питания.
- •Основные химические законы. Химический эквивалент. Закон эквивалентов. Определение молярных масс газов.
- •5.Уровни структурной организации материи. Двойственная природа микрочастиц (принципы и постулаты квантовой механики)
- •6.Характеристика состояния электрона в атоме. Правила и порядок заполнения атомных орбиталей.
- •7.Периодическая система химических элементов им. Д. И. Менделеева.
- •8.Целостные свойства атомов - масса, размер, устойчивость, их изменение по периодам и группам.
- •9.Природа и образование химической связи: метод молекулярных орбиталей (ммо). Энергия и длина связи.
- •10.Природа и образование химической связи: метод валентных связей (мвс). Ковалентная связь. Свойства ковалентной связи. Неполярная и полярная ковалентная связь.
- •12.Ионная связь. Свойства ионной связи. Свойства веществ с ионным типом связи.
- •13.Межмолекулярные взаимодействия: электростатическая, донорно-акцепторная, водородная связь и их влияние на свойства веществ.
- •14.Строение вещества в конденсированном состоянии. Зависимость физических свойств от типа химической связи в молекулах, между молекулами и ионами.
- •15.Комплексные соединения: состав, номенклатура и классификация. Применение и значение комплексных соединений.
- •16.Теории химической связи в комплексных соединениях: мвс, ммо и теория кристаллического поля (ткп).
- •18.Растворы и их классификация. Способы выражения состава растворов. Идеальные и неидеальные растворы.
- •19.Растворы электролитов. Слабые и сильные электролиты. Ионные реакции в растворах электролитов.
- •20.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Значение pH в производстве пищевых продуктов и непродовольственных товаров.
- •21.Гидролиз солей. Типичные случаи гидролиза солей.
- •22.Буферные растворы. Значение буферных растворов в природе и технике.
- •23.Понятие термодинамической системы. Функции состояния. Тепловой эффект химических процессов и изменение энтальпии.
- •24.Понятие об энтропии. Направленность химических процессов.
- •25.Скорость химических реакций: общие понятия, закон действующих масс, правило Вант-Гоффа и уранение Аррениуса.
- •26.Химическое равновесие, принцип Ле Шателье.
- •29.Свойства неметаллов и их соединений. Электронная структура неметаллов. Сродство к электрону. Электроотрицательность. Изменение свойств неметаллов по периодам и группам.
- •33.Химические свойства металлов. Сравнительная активность металлов. Коррозия металлов. Влияние различных факторов на скорость коррозии. Методы борьбы с коррозией.
- •34.Металлы и их соединения в производстве продуктов общественного питания. Макро и микроэлементы. Ксенобиотики.
- •Предмет, содержание и задачи «Неорганической химии»
- •2.Химия как наука естествознания. Основная проблема химии и общие способы её решения.
- •3.Химия и переработка продуктов общественного питания.
29.Свойства неметаллов и их соединений. Электронная структура неметаллов. Сродство к электрону. Электроотрицательность. Изменение свойств неметаллов по периодам и группам.
Неметаллы — Категория неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Свойства неметаллов:
Физические свойства неметаллов:
Химическая связь – ковалентная неполярная. Ковалентная неполярная связь - осуществляется посредством образования общих электронных пар между атомами одного и того же химического элемента.
Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии(He –гелий Ne-неон Ar-аргон Kr-криптон Xe-ксенон Rn-радон) .Многие неметаллы образуют молекулу, состоящую из двух атомов ( H2 , O2 , N2 , F2, Cl2 , Br2, I2) при этом образуется очень непрочная молекулярная неполярная кр.решетка.
Но, с другой стороны вещества с ковалентной неполярной связью образуют и самую прочную кр. решётку - атомную ( алмаз, кремний и т.д.). 1.При обычной температуре неметаллы могут быть в разном агрегатном состоянии – твердые - S –сера, P-фосфор,I –иод, C-алмаз и графи ; жидкие - Br-бром ; газообразные- O2-кислород , H2 - водород, N2- азот , Cl2-хлор, F2-фтор.
2.Многие не проводят электрический ток (кроме графита и кремния).
3.Не проводят тепло.
4.В твердом состоянии- хрупкие
5. Не имеют металлического блеска ( кроме иода-I2 , графита-C и кремния Si)
6. Цвет охватывает все цвета спектра(красный-красный фосфор, желтый –сера, зеленый-хлор, фиолетовый – пары иода).
7.tплавления изменяется в огромном интервале tпл(N2)= -2100C , а tпл(Алмаз) =37300С
8.Многие неметаллы образуют аллотропые модификации(т.е.формы)
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями, или модификациями.
Причина аллотропии - 1. строение молекулы
2.строение кристаллической решетки
1.Кислород образует две аллотропные модификации (причина- строение молекулы)
Кислород Озон
O2 O3
Газ без цвета и запаха газ бледно-фиолетового цвета с резким запахом свежести.
Обладает бактерицидными свойствами ,
способен удерживать ультрафиолетовые лучи
2. Углерод образует две аллотропные формы (причина – строение кристаллической решётки)
Алмаз Графит
Тетраэдрическая крист. решетка Кристаллическая решетка напоминает
соты слоистое кристаллическое вещество жирное на ощупь
Бесцветные кристаллы непрозрачное ,серого цвета
Самое твердое вещество в природе
tпл=37300C
Надо отметить, что аллотропные формы образуют не только неметаллы, но и металлы.
Например, олово Sn образует две модификации белое-олово (всем известный белый очень пластичный и мягкий металл, из которого делают оловянных солдатиков), при температуре - -330C белое олово превращается в серое (мелкокристаллический порошок со свойствами неметалла), этот переход называют оловянной чумой.
2.Химические свойства неметаллов: Проявляют сильные окислительные свойства, но многие могут выступать и как восстановители ( исключение -F2). Неметаллы образуют кислотные оксиды, кислоты и входят в состав солей в виде кислотных остатков. Например: S SO3 H2SO4 CaSO4*2H2O
Электронная структура неметаллов:
К неметаллам относят 22 элемента – H, B, C, Si, N, P, As, O, S, Se, Te, галогены и инертные газы, к металлам – все остальные элементы.
СРОДСТВО К ЭЛЕКТРОНУ - способность некоторых атомов и молекул присоединять добавочный электрон и превращаться в отрицательные ионы. Мерой сродства к электрону служит выделяющаяся при этом энергия. Наибольшим сродством к электрону обладают атомы галогенов (до 3-4 эВ). Отрицательное сродство к электрону означает, что присоединение электрона требует затраты соответствующей энергии.
Сродство к электрону определяет окислит. способность частицы. Молекулы с высокими значениями сродства к электрону-сильные окислители. С их помощью были получены хим. соед. благородных газов, соед. внедрения в графите.
![]()
Сродство к электрону равно энергии ионизации E отрицат. иона X-(первому потенциалу ионизации U1, измеряется в эВ). По аналогии с потенциалом ионизации различают первое и второе сродство к электрону, а также вертикальное и адиабатическое сродство к электрону многоатомной частицы.
Электроотрицательность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе общие электронные пары.
Если в двухатомной молекуле А — В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А.
изменение свойств неметаллов по периодам и группам:
Порядковый номер элемента – общее количество электронов в атоме.
Номер периода элемента – количество энергетических уровней в атоме.
Номер группы элемента – количество валентных электронов в атоме.
 группа
элементов
увеличивается число
е на внешнем энергетическом уровне
атома, уменьшается радиус атомов,
уменьшается металличность, увеличивается
неметалличность простых веществ,
основные свойства оксидов и гидроксидов
уменьшаются, кислотные - увеличиваются.
группа
элементов
увеличивается число
е на внешнем энергетическом уровне
атома, уменьшается радиус атомов,
уменьшается металличность, увеличивается
неметалличность простых веществ,
основные свойства оксидов и гидроксидов
уменьшаются, кислотные - увеличиваются.
увеличивается количество энергетических уровней в атоме, растет радиус атомов, металличность простых веществ и основные свойства оксидов и гидроксидов усиливаются, кислотные – уменьшаются.
30.Кислородные соединения неметаллов, их электролитическая и окислительно-восстановительная характеристика. Изменение свойств кислородных и водородных соединений неметаллов по группам и периодам. Основные биогены и их значение в функционировании живых систем.
Кислородные соединения неметаллов, их электролитическая и окислительно-восстановительная характеристика: С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других ― более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислота H2SO4 сильнее сернистой H2SO3.
Характеристики кислородных соединений неметаллов:
Свойства высших оксидов (т. е. оксидов, в состав которых входит элемент данной группы с высшей степенью окисления) в периодах слева направо постепенно изменяются от основных к кислотным.
В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются.
Изменение свойств кислородных и водородных соединений неметаллов по группам и периодам.
С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других – более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислота H2SO4 сильнее сернистой H2SO3.
Характеристики кислородных соединений неметалов:
Свойства высших оксидов (т.е. оксидов, в состав которых входит элемент данной группы с высшей степенью окисления) в периодах слева направо постепенно изменяются от основных к кислотным.
В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются.
С металлами водород образует (за некоторым исключением) нелетучие соединения, которые являются твердыми веществами немолекулярного строения. Поэтому их температуры плавления сравнительно высоки.
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости.
В периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливается. Это объясняется тем, что ионы кислорода имеют свободные электронные пары, а ионы водорода – свободную орбиталь, то происходит процесс, котроый выглядит следующим образом:
H2O + HF а H3O + F
Фтороводород в водном растворе отщепляет положительные ионы водорода, т.е. проявляет кислотные свойства. Этому процессу способствует и другое обстоятельство: ион кислорода имеет неподеленную электронную пару, а ион водорода – свободную орбиталь, благодаря чему образуется донорно-акцепторная связь.
При растворении аммиака в воде происходит противоположный процесс. А так как ионы азота имеют неподеленную электронную пару, а ионы водорода – свободную орбиталь, возникает дополнительная связь и образуются ионы аммония NH4+ и гидроксид-ионы ОН-. В результате раствор приобретает основные свойства. Этот процесс можно выразить формулой:
H2O + NH3 а NH4 + OH
Молекулы аммиака в водном растворе присоединяют положительные ионы водорода, т.е. аммиак проявляет основные свойства.
Теперь рассмотрим, почему водородное соединение фтора – фтороводород HF – в водном растворе является кислотой, но более слабой, чем хлороводородная. Это объясняется тем, что радиусы ионов фтора значительно меньше, чем ионов хлора. Поэтому ионы фтора гораздо сильнее притягивают к себе ионы водорода, чем ионы хлора. В связи с этим степень диссоциации фтороводородной кислоты значительно меньше, чем соляной кислоты, т.е. фтороводородная кислота слабее соляной кислоты.
Из приведенных примеров можно сделать следующие общие выводы:
В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются.
В группах сверху вниз отрицательно заряженные анионы все слабее притягивают положительно заряженные ионы водорода Н+. В связи с этим облегчается процесс отщепления ионов водорода Н+ и кислотные свойства водородных соединений увеличиваются.
Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Окислительная активность водородных соединений неметаллов в группах сверху вниз сильно увеличивается. Например, окислить фтор из водородного соединения HF химическим путем нельзя, окислить же хлор из водородного соединения HCl можно различными окислителями. Это объясняется тем, что в группах сверху вниз резко возрастают атомные радиусы, в связи с чем отдача электронов облегчается.
Основные биогены и их значение в функционировании живых систем:
Биогены (от био и ген) – это:
1) химические элементы, постоянно входящие в состав организмов и выполняющие в нем определенные биологические функции, а именно — О (эго доля около 70% массы организма), С (18%), Н (10%), N, P, S (эти первые шесть элементов составляют около 98% всей массы организма и называются органогены), а также Са, К, Na, C1 и еще десяток легких элементов, нужных организму в ничтожных количествах и называемых поэтому микроэлементами;
2) вещества, возникшие в результате разложения остатков организмов, но еще не полностью минерализованные;
3) вещества, происходящие от живого организма, связанные с его жизнедеятельностью (фитонциды и др.);
4) вещества - стимуляторы, обладающие высокой биологической активностью (в основном используются в профилактических и лечебных целях).
Биогены - У растений - ион или молекула, поглощаемые из окружающей среды и содержащие в своем составе незаменимые элементы (например, углерод, водород, азот, фосфор, сера - незаменимые элементы, а углекислый газ, вода, нитраты и аммоний, фосфаты и сульфаты - соответствующие биогены). У животных - вещества типа аминокислот, витаминов и минеральных солей, необходимые для роста тканей и жизнедеятельности организма.
31.Общие свойства металлов. Положение металлов в периодической системе. Зависимость свойств металлов от строения электронных оболочек. Кристаллическая решетка металлов. Металлическая связь. Металлы в природе, способы их получения и применение.
Общие свойства металлов
МЕТАЛЛЫ (от греч. metallon-первоначально, шахта, копи), в-ва, обладающие в обычных условиях характерными, металлическими, свойствами-высокими электрич. проводимостью и теплопроводностью, отрицат. температурным коэф. электрич. проводимости, способностью хорошо отражать световые волны (блеск), пластичностью. К металлам относятся как собственно металлы (простые в-ва), так и их сплавы, металлические соединения, в т.ч. интерметаллиды. Иногда металлами наз. все в-ва, обладающие теми или иными металлич. св-вами, напр. т. наз. "синтетические" металлы, металлы органические.
К металлам относят простые вещества, образованные атомами элементов, имеющих небольшое число (от 1 до 4) электронов на внешнем энергетическом уровне. Атомы металлов обладают тенденцией к отдаче электронов, поэтому для них характерна высокая восстановительная активность, определяющаяся низкими значениями энергии ионизации (Eи) валентных электронов атомов. Известно, что в пределах одного периода величина Eи возрастает с увеличением порядкового номера элемента, а в главных подгруппах - уменьшается. Такая тенденция изменения восстановительной активности атомов и объясняет тот факт, что элементы-металлы находятся в Периодической системе (длиннопериодный вариант) левее диагонали "бор - астат".
К металлам относят s-элементы (за исключением H и He), d- и f-элементы, а также p-элементы, расположенные левее и ниже указанной диагонали (т.е. более 80% элементов, входящих в ПС). При этом следует помнить, что деление элементов на металлы и неметаллы является условным (об этом свидетельствует наличие так называемых амфотерных элементов, которые группируются у отмеченной выше диагонали). Для них характерна малая электроотрицательность (ЭО) (в рамках шкалы ЭО по Полингу считают, что для атомов металлов величина ЭО меньше 2). Этим обусловлена способность атомов металлов образовывать центры только положительных зарядов в молекулах, элементарных и сложных ионах:
![]()
Положение металлов в периодической таблице
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп), а справа вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером.
К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго).
Зависимость свойств металлов от строения электронных оболочек.
Все многообразие физико-химических свойств различных веществ определяется особенностями строения электронных оболочек их атомов. Внешние, так называемые валентные, электроны у всех металлов относительно слабо связаны с ядром. Элементы-металлы легко отдают внешние валентные электроны, вступая в химические реакции с элементами-неметаллами, при приложении ничтожной разности электрических потенциалов и т. д. Слабой связью внешних валентных электронов с ядром и объясняются характерные металлические свойства.
Кристаллическая решетка металлов
Кристаллическая решетка — воображаемая пространственная сетка, в узлах которой располагаются частицы, образующие твердое (кристаллическое) тело.
В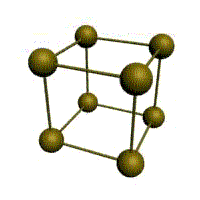 се
металлы являются кристаллическими
телами, имеющими определенный тип
кристаллической решетки, состоящей из
малоподвижных положительно заряженных
ионов, между которыми движутся свободные
электроны (так называемый электронный
газ). Такой тип структуры называется
металлической связью.
се
металлы являются кристаллическими
телами, имеющими определенный тип
кристаллической решетки, состоящей из
малоподвижных положительно заряженных
ионов, между которыми движутся свободные
электроны (так называемый электронный
газ). Такой тип структуры называется
металлической связью.
Кубическая (1 атом на ячейку)
о
 бъемно-центрированная
кубическая (ОЦК) (2 атома на ячейку)
бъемно-центрированная
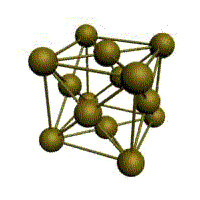
кубическая (ОЦК) (2 атома на ячейку)гранецентрированная кубическая (ГЦК) (4 атома на ячейку)
4. гексагональная плотноупакованная (ГП) (6 атомов на ячейку)
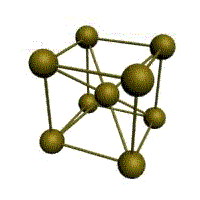
О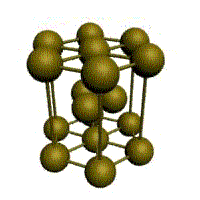 снову
ОЦК-решетки составляет элементарная
кубическая ячейка в которой положительно
заряженные ионы металла находятся в
вершинах куба, и еще один атом в центре
его объема, т. е. на пересечении его
диагоналей. Такой тип решетки в
определенных диапазонах температур
имеют железо, хром, ванадий, вольфрам,
молибден и др. металлы.
снову
ОЦК-решетки составляет элементарная
кубическая ячейка в которой положительно
заряженные ионы металла находятся в
вершинах куба, и еще один атом в центре
его объема, т. е. на пересечении его
диагоналей. Такой тип решетки в
определенных диапазонах температур
имеют железо, хром, ванадий, вольфрам,
молибден и др. металлы.
У ГЦК-решетки (рис. 1.2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 1.2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Металлическая связь
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Металлы в природе, способы их получения и применение.
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов[источник не указан 708 дней]. Больше всего в наших клетках кальция и натрия, сконцентрированного в лимфатических системах. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Способы получения металлов:
Восстановление:
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия
4Аl + ЗМnО2 = 2А12О3 + ЗМn
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем)
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
Электролизом расплавов солей
СuСl2, — Сu2+ 2Сl
Катод (восстановление): Анод (окисление):
Сu2+ 2е- = Сu0 2Cl - 2е- = Сl°2
Применение металлов
Конструкционные материалы Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
