
- •12. Элементы органической
- •12.1. Введение
- •12.2. Особенности органических соединений
- •12.3. Тип химических связей и валентность углерода в органических соединениях
- •12.4. Основные положения теории
- •Химического строения органических
- •Соединений
- •А. М. Бутлерова
- •Изомерия положения функциональной группы:
- •III. В молекулах органических веществ атомы и группы атомов влияют друг на друга. Это взаимное влияние определяет свойства веществ.
- •12.5. Классификация органических
- •12.6. Номенклатура органических соединений
- •12.8. Углеводороды
- •12.8.1. Классификация углеводородов
- •12.8.2. Алканы (парафины) Определение, общая формула
- •Изомерия и номенклатура алканов
- •Химические свойства алканов
- •II. Реакции окисления
- •IV. Реакции крекинга алканов
- •V. Изомеризация
- •Получение алканов
- •Применение
- •12.8.2. Алкены (олефины, этиленовые ув) Определение, общая формула
- •I. Реакции присоединения
- •III. Реакции полимеризации
- •IV. Изомеризация.
- •V. Реакции замещения
- •Получение
- •Реакции присоединения
- •12.8.4. Алкины (ацетиленовые ув)
- •Изомерия и номенклатура
- •Химические свойства
- •II.Реакции окисления
- •III. Реакции полимеризации
- •IV. Реакции замещения атомов «н», связанных с sp-гибридизованными атомами углерода
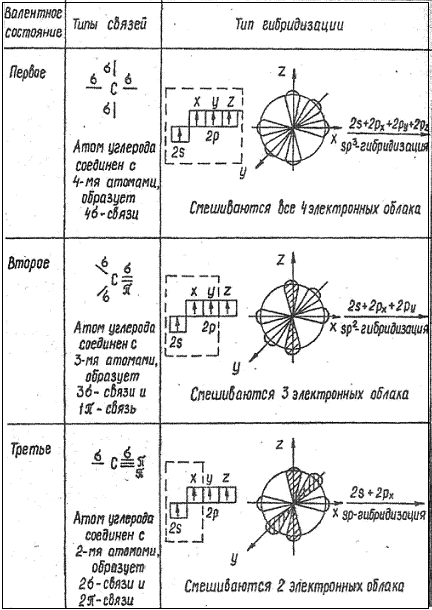
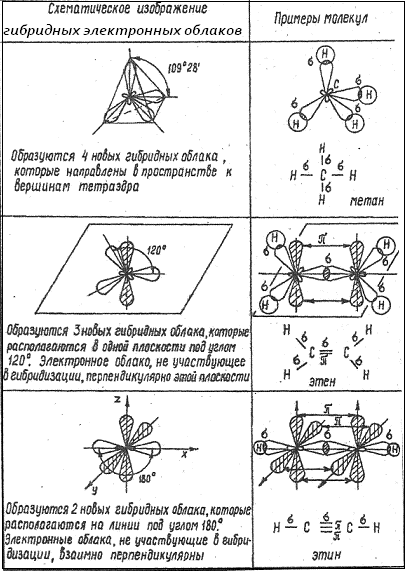
12.3. Тип химических связей и валентность углерода в органических соединениях
Атом углерода образует только ковалентные связи. Это объясняется тем, что углерод имеет электроотрицатеьность (ЭО) = 2,5, что является промежуточной величиной между значениями ЭО типичных металлов (ЭО = 0,7—1,5) и ЭО типичных неметаллов (ЭО = 3,0 ÷ 4,0).
Рассмотрим валентные возможности атома углерода:
6С 1s2 2s2 2p2 C* 1s2 2s1 2p3
валентные
ē-ны
↑
↑
↑
↑
↑
↑↓
↑
2p 2p
2s 2s
основное возбуждённое
состояние состояние
В=2 В*=4
Во всех органических соединениях атом С находится в возбуждённом состоянии, и поэтому валентность С равна 4.
Атом углерода в органических соединениях может находиться в трёх валентных состояниях (табл.1). Этим валентным состояниям соответствуют различные типы гибридизации атомных орбиталей (облаков) атома углерода.
Таблица 1.
Валентные состояния и типы гибридизации атома углерода.
12.4. Основные положения теории
Химического строения органических
Соединений
А. М. Бутлерова
Химическая природа органических соединений, свойства, отличающие их от соединений неорганических, а также их многообразие нашли объяснение в сформулированной Бутлеровым в 1861 г. теории химического строения органических веществ. Основные положения данной теории:
I. Атомы в молекулах органических веществ соединяются друг с другом в определенной последовательности согласно их валентности. Последовательность соединения атомов в молекуле называется химическим строением (структурой).

 Формулы
Формулы
Эмпирические- структурные-
(брутто-формулы)- показывают химическое
показывают только строение веществ
состав веществ
С
 2Н4,
С2Н6,
С2Н6О
H
H
2Н4,
С2Н6,
С2Н6О
H
H
С = С
H H
(H2C = CH2)
H H H H
׀ ׀ ׀ ׀
H– C – C – H H– C – C – O –H
׀ ׀ ׀ ׀
H H H H
(CH3 – CH3) (CH3–CH2–OH)
В органических соединениях, как уже отмечалось, атомы углерода могут соединяться друг с другом, образуя цепи (углеродный скелет).
В образующихся цепях атом углерода может быть связан либо с одним соседним атомом углерода, либо с двумя, либо с тремя, либо с четырьмя. Соответственно различают первичные, вторичные, третичные и четвертичные атомы углерода. В зависимости от наличия тех или иных атомов углерода цепи бывают:
а) прямые (неразветвленные) — содержат два первичных атома углерода (крайние в цепи), остальные атомы — вторичные; например:
׀ ׀ ׀ ׀ ׀
– C – C – C – C – C – ;
׀ ׀ ׀ ׀ ׀
б) разветвленные — содержат хотя бы один третичный или хотя бы один четвертичный атом углерода; например:
׀ ׀ ׀ ׀
 – C
– C – C – C –
– C
– C – C – C –
 ׀
׀ ׀ ׀
׀
׀ ׀ ׀
– C –
׀
третичный атом
углерода
в) замкнутые (циклы) — не содержат первичных атомов углерода; например:


С – С

С С С

С –
С С
С
II. Свойства веществ зависят не только от состава, но и от строения их молекул.
Огромной заслугой А. М. Бутлерова является то, что он первым объяснил явление изомерии.
Изомерия – это явление существования веществ, имеющих одинаковый качественный и количественный состав, но различное строение или различную пространственную конфигурацию молекул и, соответственно, различные свойства. Эти вещества называются изомерами.
Например, существуют 2 различных вещества, которые имеют одинаковый состав, выражаемый эмпирической формулой С2Н6О:
Изомеры

С2Н6О


Н–Н Н Н
׀ ׀ ׀ ׀
Н – С – С – О –Н Н – С – О – С – Н
׀ ׀ ׀ ׀
Н – Н Н Н
СН3–СН2–ОН СН3–О–СН3
Этанол (жидкость, взаимо- Диметиловый эфир (газ, не
действует с Na) взаимодействует с Na)
Изомеры имеют одинаковую эмпирическую формулу и разные структурные формулы. С увеличением числа атомов углерода в молекуле число изомеров резко возрастает; например:
С4Н10 – 2 изомера,
С10Н22 – 75 изомеров.
Типы изомеров
1. Структурная изомерия обусловлена различным порядком связей углеродных атомов (изомерия скелета) или различным расположением функциональных групп или кратных связей(изомерия положения).
Изомерия Изомерия положения
цепи: кратной связи:
1 2 3 4
 СН3
– СН2
–СН2
– СН3
СН3
– СН
= СН
– СН3
СН3
– СН2
–СН2
– СН3
СН3
– СН
= СН
– СН3


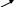
С 4Н10
С4Н8
4Н10
С4Н8
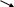 1 2 3 4
1 2 3 4
СН3 – СН – СН3 СН2=СН– СН2 – СН3
׀
СН3
