
- •Часть 1
- •Содержание
- •Глава 1. Общая характеристика и классификация свободных радикалов. Активированные кислородные метаболиты.
- •Характерные значения времен жизни и радиусов диффузии акм в биологических субстратах
- •Метаболизм свободных радикалов (Владимиров ю.А., 1998)
- •Биологические эффекты акм в живых системах
- •Контрольные вопросы
- •Глава 2. Характеристика активных форм кислорода, их биологическая роль (физиологические и патологические эффекты)
- •2.1. Синглетный кислород
- •Пути образования синглетного кислорода в биосистемах
- •Химические реакции 1о2.
- •Биологическое значение 1о2
- •2.2. Супероксидный анион-радикал
- •2. Окислительно-восстановительные процессы, катализируемые металлофлавопротеидами, а также электрон-транспортные цепи митохондрий и микросом
- •Биологическая роль ксантиноксидазы
- •2.2. Образование супероксидного анион-радикала в митохондриях
- •2.3. Образование супероксидного анион-радикала в микросомах
- •2.4. Образование супероксидного анион-радикала надфн-оксидазой
- •Структура надфн-оксидазы
- •Каталитический цикл надфн-оксидазы
- •Биологические эффекты о2..
- •2.3. Перекись водорода
- •Н2о2-сенсоры легких и кровеносных сосудов
- •2.4. Гидроксильный радикал
- •Биологические эффекты он-радикалов:
- •Глава 3. Характеристика гипогалогенитов и путей их образования
- •Биологическая роль мпо:
- •Контрольные вопросы
- •Глава 4. Оксид азота как регулятор клеточных функций
- •Двойственные функции no: посредник и токсин
- •Контрольные вопросы
- •Список литературы
Биологические эффекты он-радикалов:
- участвуют в бактерицидном и цитотоксическом действии лейкоцитов;
- вызывают повреждение ДНК. Модификация оснований ДНК в результате действия ОН. приводит к опухолевой траснформации пораженных клеток, а также к образованию аутоантител к трансформированной ДНК и индукции аутоиммунных процессов;
- вызывают модификацию мембранных белков;
- индуцируют образование липидных радикалов и запускают ПОЛ;
- обладают косвенными регуляторными свойствами: участвуют в активации тромбоцитов, активируют растворимую гуанилатциклазу.
В целом, цитотоксическое действие кислородных радикалов более чем на 50 % обусловлено ОН-радикалами.
Контрольные вопросы
Охарактеризуйте синглетный кислород и его биологическую роль
Каковы основные пути образования супероксидного анион-радикала в организме?
Как функционирует ксантиноксиредуктаза? Каково ее биологическое значение?
Как функционирует электрон-транспортная цепь митохондрий? Где локализована сайты образования супероксида?
Как образуется супероксид в системе микросомального окисления?
Каково строение, функции и биологическая роль НАДФН-оксидазы фагоцитов?
В чем проявляются регуляторные и цитоксические эффекты перекиси водорода?
Как функционирует Н2О2-сенсор в живых организмах?
Каковы пути образования гидроксильного радикала в живых системах? Какова его биологическая роль?
Какова роль АФК в индукции апоптоза в митохондриях?
Глава 3. Характеристика гипогалогенитов и путей их образования
Гипогалогениты относятся к активированным кислородным метаболитам и представляют собой активные формы галогенов.
В организме человека гипогалогениты образуются в ферментативной реакции перекиси водорода с ионами галогенов, которая катализируется миелопероксидазой (МПО), эозинпероксидазой (ЭПО), лактопероксидазой (ЛПО), которые различаются по структуре и субстратной специфичности:
МПО,ЭПО
Н2О2 + х- + Н+ → НОХ + Н2О, где х- - Cl-, I-, Br-, SCN-
ЛПО
Миелопероксидаза – основной пероксидазосомный белок нейтрофилов, моноцитов и тканевых макрофагов, играющий ключевую роль в защитных и воспалительных реакциях организма. Наибольшее содержание МПО отмечено в нейтрофилах, где на долю фермента приходится более 30 % от общего содержания белка.
МПО – катионный, гликозилированный белок, является гемопротеином с молекулярной массой 144 кДа. МПО состоит из двух тяжелых () и двух легких (α) субъединиц; -субъединицы соединены дисульфидной связью и содержат 2 молекулы протопорфирина IX с ионом Fe3+ в центре. Гемы соединены а апопротеинами двумя сложноэфирными связями и одной сульфоновой связью. Такой тройной тип связи гема является уникальным по сравнению с другими гемовыми белками. Ген, кодирующий МПО, расположен в 17 хромосоме. МПО катализирует двухэлектронное окисление хлорида с образованием гипохлорита:
Н2О2 + Cl- + H+ → HOCl + H2O
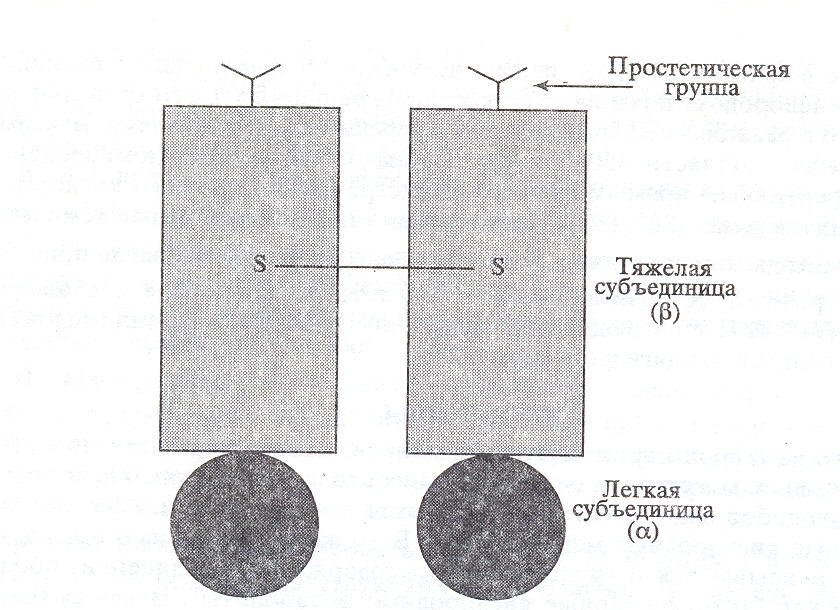
Рис. 12. Структура миелопероксидазы
В результате каталитического цикла железо гема претерпевает последовательное окисление и восстановление. Нативная МПО (феррифермент МПО-Fe3+) реагирует с перекисью водорода и образует соединение I (МПО-Fe4+=O), которое содержит два окислительных эквивалента по сравнению с ферриформой (реакция 1 на схеме). Соединение I нестойкое, обладает высокой реакционной способностью и катализирует двухэлектронное окисление галогенидов до гипогалоидных кислот с образованием нативной ферриформы фермента (реакция 2 на схеме).
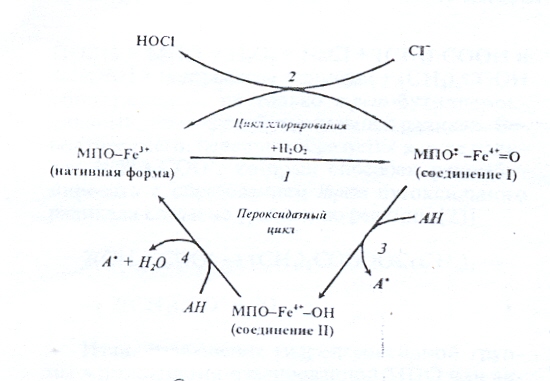
Рис. 13. Схема превращений МПО
Реакции 1 и 2 (схема) представляют собой цикл хлорирования.
В присутствии одноэлектронных доноров водорода (АН-фенолы, анилины, -дикетоны, нитрит и др.) соединение I может восстанавливаться в соединение II (МПО- Fe4+-OН), которое не участвует в образовании НОCl (реакция 3 на схеме). Соединение II, как и соединение I, катализирует окисление АН, превращаясь при этом в нативный фермент (реакция 4 на схеме). Реакции 1,3 и 4 (схема) представляют собой классический пероксидазный цикл. Относительная концентрация Cl- и АН определяет механизм реакции, по которой будет функционировать фермент (хлорирование или пероксидация).
МПО образует целый ряд окислителей при переходе в соединения I и II, а некоторые реакции НОCl ведут к дальнейшей генерации АФК:
НОCl + H2O2 → 1О2 + Cl- + H+ + H2O
НОCL + О2. → ОН. + Cl- + O2
НОCl + Fe2+ → Fe3+ + ОН. + Cl-
HOCl + NO2. → NO2Cl + OH.
В 1952 году Чанс установил кофакторную роль NO2., затем была показана такая же роль NO:
Оксид азота влияет на МПО двумя путями:
- при низкой [H2O2] NO. усиливыает активность МПО и образование НОCl, т.е. стимулирует бактерицидную функцию фермента;
- при высокой [H2O2] активирующий эффект минимален, так как создается неактивный комплекс NO. с ферри-МПО. Лигандирование оксида азота с гемом препятствует доступу H2O2 к каталитическому центру МПО.
При реакции оксида азота с соединениями I и МПО образуется катион нитрозония NO+, который не стабилен и быстро переходит в продукт его гидратации NO2- . NO2- является кофактором МПО, он образует комплекс с ферментом и меняет реакционный профиль HOCl за счет образования нитрохлорида NO2Cl. При этом маркером действия HOCl является 3-хлортирозин.
Система МПО существует не только как источник антимикробной HOCl, но и как катализатор бактерицидных реакций нитрования микробных и других патогенных белков.
