
- •1. Расчетные химические задачи, их типы, овладение уч-ся по годам. Методические приемы формирования у уч-ся умения решать расчетные задачи по химии.
- •2. Растворы
- •4. Внеклассная работа по химии, её принципы, формы, направления.
- •7. Индивид. И дифференцир. Подходы к уч-ся в процессе обучения.
- •10. Методика формирования основ. Хим. Понятий. Этапы и пути. Развитие основн. Хим. Понятий.
- •11. Понятие о внутр. Энергии сис-мы и энтальпии. Теплота р-и, её термодинамические и термохимические обозначения. Закон Гесса и следствия из него.
- •13. Химический язык в школе. Структура. Значение формирования знаний химического языка.
- •14. Окислительно-восстановительные реакции.
- •17. Политехнизация знаний по химии.
- •18. Общая характеристика разбавленных р-ов неэлектролитов. Свойства р-ов. Роль осмоса в биологических процесса.
- •19. Производные карбоновых кислот: соли, галогенангидриды, ангидриды, эфиры, амиды и их взаимные переходы. Механизм реакции этерификации.
- •21. Формирование научного мировоззрения уч-ся при изучении химии в школе.
- •22. Химическая связь.
- •24. Методы обучения химии. Их клас-ция. Развив. Ф-ции.
- •25. Ионная связь.
- •26. Фенолы
- •Физические свойства
- •Химические свойства
- •26. Фенолы. Методы получения. Химические свойства: кислотность (влияние заместителей), реакции по гидроксильной группе и ароматическому кольцу.
- •27. Лекционно-семинарская система занятий по химии. Хар-ка структ. Эл-тов с-мы.
- •28. Общая характеристика и электронное строение атомов элементов V группы главной подгруппы. Аммиак, строение молекул, получение и свойства.
- •Аммиак (nh3)
- •29. Альдегиды, кетоны и карбоновые кислоты ароматического ряда. Способы получения и химические свойства.
- •30. Уроки обобщения знаний и умений уч-ся. Их особ-сти, класс-ция. Пути систематизации знаний.
- •31. Кислоты, основания, соли с точки зрения тэд.
- •33. Принципы обучения химии.
- •34. Обратимые и необратимые реакции.
- •36. Особенности урока химии как осн. Орг. Формы обучения. Типы, клас-ция уроков изучения новых знаний. Факторы, определяющие кач-во этих уроков.
- •37. Квантово-механическая модель строения атома.
- •39.Структура основных химических понятий, их формирование и развитие.
- •41. Ферменты
- •42. Наглядность в обучении химии. Виды и методы ее использования на уроках.
- •43. Металлы
- •44.Биосинтез белка. Этапы белкового синтеза. Строение рибосом и их роль в биосинтезе белка.
- •45. Химический кабинет в школе.
- •46. IV группа, гл. Подгруппа
- •Углерод
- •47. Рнк. Типы рнк. Структура рнк.Роль тРнк в биосинтезе белка.
- •48.Пути развития мышления учащихся при изучении химии в средней школе.
- •50. Одно – и многоатомные спирты
- •I. Реакции замещения
- •II. Реакции отщепления
- •III. Реакции окисления
- •II. Замещение гидроксильных групп
- •51.Демонстрационный эксперимент в обучении химии
19. Производные карбоновых кислот: соли, галогенангидриды, ангидриды, эфиры, амиды и их взаимные переходы. Механизм реакции этерификации.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R-СО-Х; здесь R означает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу (R-СN), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот.
Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
R-СО-ОН + РСl5-----> R-СО-Сl + РОСl3 + НСl.
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств:
2R-СО-ОН + Р2О5-----> (R-СО-)2О + 2НРО3.
Соли получают при реакции кислот с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RСООН + Мg —> (RСОО)2Мg + Н2
2RСООН + СаО —> (RСОО)2Са + Н2О
RСООН + NaОН —>RСООNа + Н2О
RСООН + NаНСОз —> RСООNа + Н2О + СО2
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации): R-СО-ОН + HOR' —> R-СО-ОR' + Н2О
Механизм реакции этерификации был установлен методом "меченых атомов". Если использовать спирт, «меченный» изотопом 18О, то «меченный» кислород входит в молекулы сложного эфира, но не воды. Это доказывает, что разрыв связей в этой реакции происходит следующим образом:
R−СО−/ОН + H −/18O−R' ↔ R−СО − 18O−R' + H2O
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
R-СО-С1 + Na-О-R'-----> R-СО-ОR' + NaCl
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
СНз-СО-Сl + NН3 -----> СН3-СО-NН2 + НСl
Кроме того, амиды могут быть получены при нагревании аммонийных солей карбоновых кислот:
СН3-СООNН4 -----> СН3-СО-МН2 + Н2О.
При нагревании амидов в присутствии водоотнимающих средств они дегидратируются с образованием нитрилов:
Р205
СНз-СО-NН2--------» СНз-С≡N + Н2О
Функциональные производные низших кислот — летучие жидкости. Все они легко гидролизуются с образованием исходной кислоты:
R-СО-Х + Н2О-----> R-СО-ОН + НХ.
В кислой среде эти реакции могут быть обратимы. Гидролиз в щелочной среде необратим и приводит к образованию солей карбоновых кислот, например:
R-СО-ОR' + NaOН-----> Н-СО-ОNа + R'ОН
Гидролиз нитрилов. Например, нитрил уксусной кислоты (метилцианид) при нагревании легко гидролизуется с образованием ацетата аммония:
СНзСN + 2Н2О-----> СНзСООNH4.
При подкислении раствора выделяется кислота:
СНзСООNH4. + НСl —> СНзСООН + NH4Cl.
Различные производные карбоновых кислот могут переходить друг в друга.
Так, из хлорангидридов можно получить:
Реакцией с NН3 — амиды,
Реакцией с алкоголятами щелочных металлов — сложные эфиры,
Из ангидридов можно получить:
Реакцией со щелочами — соль и кислоту,
Реакцией со спиртами – сложные эфиры.
20. Алкины. Это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизациии связаны друг с другом тройной связью: -С=С- Существует два вида изомерии: изомерия положения тройной связи и изомерия цепи. Алкины изомерны алкадиенам: СН3-СН2-С=СН С4Н6 СН2=СН-СН=СН2
Номенклатура
Химические свойства6
1. Реакции присоединения, аналогичне присоединеню к алкена. Могут протекать с присоедтнением 1 или 2 моль реагента по радикальным или ионным механизмам R-C=C-H R-C=C-B R-C-C-B
2. Реакции отщепления терминального атома водорода сильными основаниями
R-C=C-H R-C=C R-C=C-E
3. Специфические реакции присоединения:
- гидратация R-C=C + H2O R-C=C R-C-H
реакции с нуклеофильными реагентами
- реакции с участием ацетилиданионов
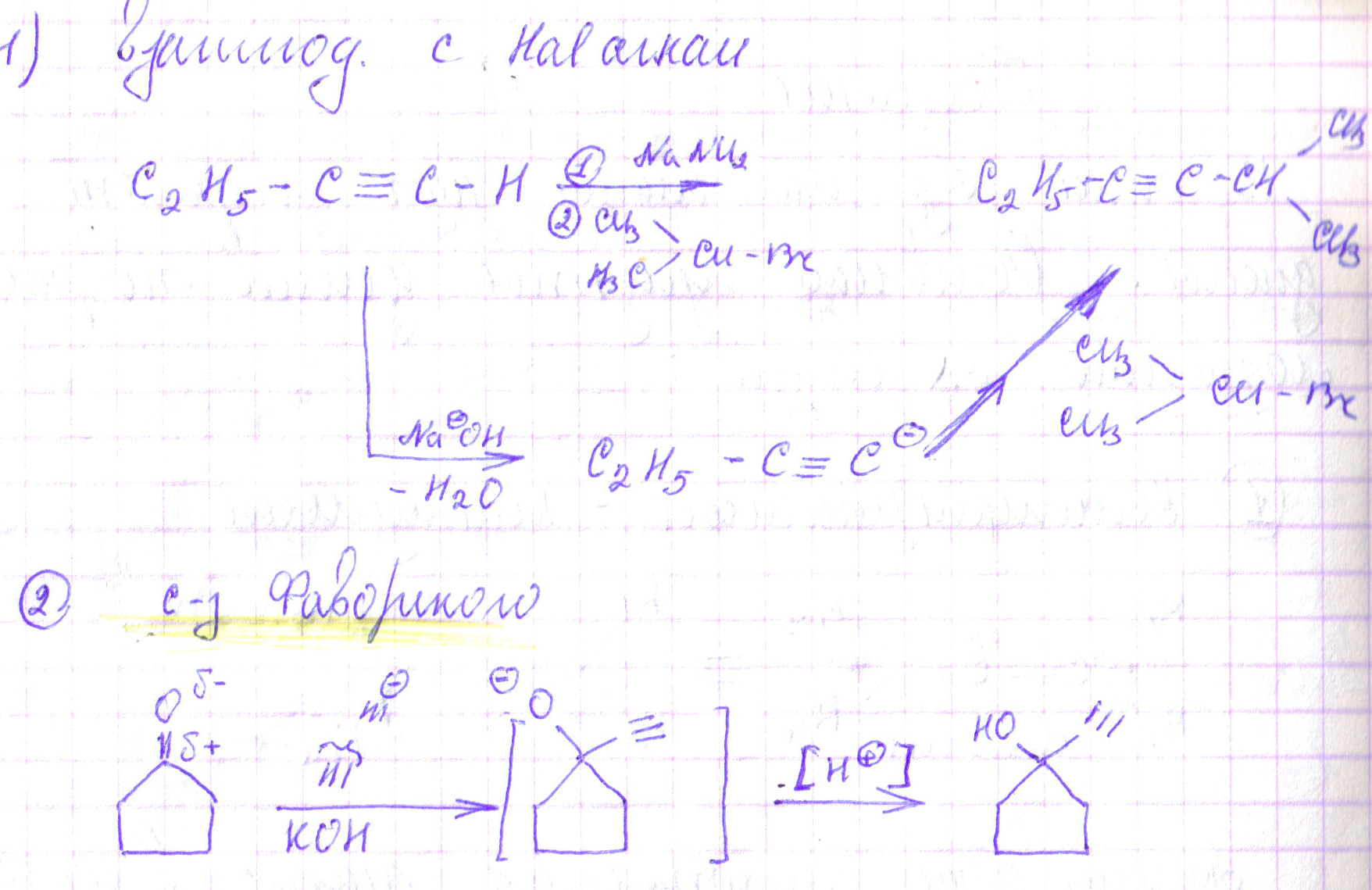
Синтез
Модификация концевых алкинов
Реакции отщепления (илиминирования)
Дегидротация R-CH-CH-OH R-C=CH
Реакции сочетания C6H5-J + CH=C-Ph C6H5-C=C-Ph
