
- •1. Расчетные химические задачи, их типы, овладение уч-ся по годам. Методические приемы формирования у уч-ся умения решать расчетные задачи по химии.
- •2. Растворы
- •4. Внеклассная работа по химии, её принципы, формы, направления.
- •7. Индивид. И дифференцир. Подходы к уч-ся в процессе обучения.
- •10. Методика формирования основ. Хим. Понятий. Этапы и пути. Развитие основн. Хим. Понятий.
- •11. Понятие о внутр. Энергии сис-мы и энтальпии. Теплота р-и, её термодинамические и термохимические обозначения. Закон Гесса и следствия из него.
- •13. Химический язык в школе. Структура. Значение формирования знаний химического языка.
- •14. Окислительно-восстановительные реакции.
- •17. Политехнизация знаний по химии.
- •18. Общая характеристика разбавленных р-ов неэлектролитов. Свойства р-ов. Роль осмоса в биологических процесса.
- •19. Производные карбоновых кислот: соли, галогенангидриды, ангидриды, эфиры, амиды и их взаимные переходы. Механизм реакции этерификации.
- •21. Формирование научного мировоззрения уч-ся при изучении химии в школе.
- •22. Химическая связь.
- •24. Методы обучения химии. Их клас-ция. Развив. Ф-ции.
- •25. Ионная связь.
- •26. Фенолы
- •Физические свойства
- •Химические свойства
- •26. Фенолы. Методы получения. Химические свойства: кислотность (влияние заместителей), реакции по гидроксильной группе и ароматическому кольцу.
- •27. Лекционно-семинарская система занятий по химии. Хар-ка структ. Эл-тов с-мы.
- •28. Общая характеристика и электронное строение атомов элементов V группы главной подгруппы. Аммиак, строение молекул, получение и свойства.
- •Аммиак (nh3)
- •29. Альдегиды, кетоны и карбоновые кислоты ароматического ряда. Способы получения и химические свойства.
- •30. Уроки обобщения знаний и умений уч-ся. Их особ-сти, класс-ция. Пути систематизации знаний.
- •31. Кислоты, основания, соли с точки зрения тэд.
- •33. Принципы обучения химии.
- •34. Обратимые и необратимые реакции.
- •36. Особенности урока химии как осн. Орг. Формы обучения. Типы, клас-ция уроков изучения новых знаний. Факторы, определяющие кач-во этих уроков.
- •37. Квантово-механическая модель строения атома.
- •39.Структура основных химических понятий, их формирование и развитие.
- •41. Ферменты
- •42. Наглядность в обучении химии. Виды и методы ее использования на уроках.
- •43. Металлы
- •44.Биосинтез белка. Этапы белкового синтеза. Строение рибосом и их роль в биосинтезе белка.
- •45. Химический кабинет в школе.
- •46. IV группа, гл. Подгруппа
- •Углерод
- •47. Рнк. Типы рнк. Структура рнк.Роль тРнк в биосинтезе белка.
- •48.Пути развития мышления учащихся при изучении химии в средней школе.
- •50. Одно – и многоатомные спирты
- •I. Реакции замещения
- •II. Реакции отщепления
- •III. Реакции окисления
- •II. Замещение гидроксильных групп
- •51.Демонстрационный эксперимент в обучении химии
26. Фенолы
Фенолы — это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца.
Классификация: Одноатомные, Двуатомные, Трехатомные.
Номенклатура и изомерия
Возможны два типа изомерии: изомерия положения заместителей в бензольном кольце и изомерия боковой цепи (строения алкильного радикала и числа радикалов).
Многие фенолы имеют тривиальные названия.
С6H5OH – фенол
Э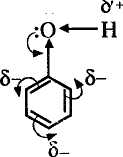 лектронное
строение
лектронное
строение
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа — ОН — положительным. Дипольный момент направлен в сторону бензольного кольца.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол С6Н5ОН (карболовая кислота) — бесцветное кристаллическое вещество, 1°тят = 43°С, /°кип = 182°С, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66°С смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы — ОН и бензольного кольца.
I. Реакции с участием гидроксильной группы
Кислотные свойства
1) Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):
C6H6OH + NaOH = C6H6ONa + H2O фенолят натрия
3) Взаимодействие с активными металлами с образованием фенолятов
2C6H6OH + 2K = 2C6H6OK + H2
Образующиеся в результате реакций 2) и 3) феноляты легко разлагаются при действии кислот. C6H6ONa + H2CO3 = C6H6OH + NaHCO3
Феноляты используются в качестве исходных веществ для получения простых и сложных эфиров фенола: C6H6ONa + CH3CH2Br = C6H6-OCH2CH3 + NaBr
II. Реакции с участием бензольного кольца
1. Реакции замещения
Реакции замещения в бензольном кольце фенолов протекают легче, чем у бензола, и в более мягких условиях.
Галогенирование. 2C6H6OH + 2Cl2 = C6H5OHCl + C6H5OHCl (к разным атомам)
Нитрование. C6H6OH + 3HONO2 =H2SO4 конц= С6H3OH-(NO2)3 2,4,6-тринитрофенол
Сульфирование (c H2SO4). Соотношение о- и n-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t°= 100°С — пара-изомер.
2. Реакции присоединения. C6H6OH + 3H2 = Ni, 150C, P= C6H12OH циклогексанол
III. Качественные реакции на фенолы
В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) FeCl3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления сильной кислоты.
Способы получения
1. Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем — кислотой:
С6Н5ОН + NaOH = C6H5ONa + Н2О Фенолят натрия (промежуточный продукт)
C6H5ONa + H2SO4 = C6H5OH + NaHSO4
2. Сплавление солей аренсульфокислот со щелочью:
C6H6SO3Na + NAOH =300C= C6H6OH + Na2SO3
3. Взаимодействие галогенпроизводных ароматических УВ со щелочами:
C6H5Cl + NaOH =300C, P, Cu= C6H5OH + NaCl
C6H5Cl + HOH пар =450-500C, Al2O3= C6H5OH + NaCl
4. Кумольный способ. В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям.
