
- •1. Расчетные химические задачи, их типы, овладение уч-ся по годам. Методические приемы формирования у уч-ся умения решать расчетные задачи по химии.
- •2. Растворы
- •4. Внеклассная работа по химии, её принципы, формы, направления.
- •7. Индивид. И дифференцир. Подходы к уч-ся в процессе обучения.
- •10. Методика формирования основ. Хим. Понятий. Этапы и пути. Развитие основн. Хим. Понятий.
- •11. Понятие о внутр. Энергии сис-мы и энтальпии. Теплота р-и, её термодинамические и термохимические обозначения. Закон Гесса и следствия из него.
- •13. Химический язык в школе. Структура. Значение формирования знаний химического языка.
- •14. Окислительно-восстановительные реакции.
- •17. Политехнизация знаний по химии.
- •18. Общая характеристика разбавленных р-ов неэлектролитов. Свойства р-ов. Роль осмоса в биологических процесса.
- •19. Производные карбоновых кислот: соли, галогенангидриды, ангидриды, эфиры, амиды и их взаимные переходы. Механизм реакции этерификации.
- •21. Формирование научного мировоззрения уч-ся при изучении химии в школе.
- •22. Химическая связь.
- •24. Методы обучения химии. Их клас-ция. Развив. Ф-ции.
- •25. Ионная связь.
- •26. Фенолы
- •Физические свойства
- •Химические свойства
- •26. Фенолы. Методы получения. Химические свойства: кислотность (влияние заместителей), реакции по гидроксильной группе и ароматическому кольцу.
- •27. Лекционно-семинарская система занятий по химии. Хар-ка структ. Эл-тов с-мы.
- •28. Общая характеристика и электронное строение атомов элементов V группы главной подгруппы. Аммиак, строение молекул, получение и свойства.
- •Аммиак (nh3)
- •29. Альдегиды, кетоны и карбоновые кислоты ароматического ряда. Способы получения и химические свойства.
- •30. Уроки обобщения знаний и умений уч-ся. Их особ-сти, класс-ция. Пути систематизации знаний.
- •31. Кислоты, основания, соли с точки зрения тэд.
- •33. Принципы обучения химии.
- •34. Обратимые и необратимые реакции.
- •36. Особенности урока химии как осн. Орг. Формы обучения. Типы, клас-ция уроков изучения новых знаний. Факторы, определяющие кач-во этих уроков.
- •37. Квантово-механическая модель строения атома.
- •39.Структура основных химических понятий, их формирование и развитие.
- •41. Ферменты
- •42. Наглядность в обучении химии. Виды и методы ее использования на уроках.
- •43. Металлы
- •44.Биосинтез белка. Этапы белкового синтеза. Строение рибосом и их роль в биосинтезе белка.
- •45. Химический кабинет в школе.
- •46. IV группа, гл. Подгруппа
- •Углерод
- •47. Рнк. Типы рнк. Структура рнк.Роль тРнк в биосинтезе белка.
- •48.Пути развития мышления учащихся при изучении химии в средней школе.
- •50. Одно – и многоатомные спирты
- •I. Реакции замещения
- •II. Реакции отщепления
- •III. Реакции окисления
- •II. Замещение гидроксильных групп
- •51.Демонстрационный эксперимент в обучении химии
Расчетные химические задачи. Типы расчетных химических задач и их овладение учащимися по годам обучения. Общие методические приемы формирования у школьников умения решать расчетные задачи по химии.
Растворы, их концентрация. Насыщенные, ненасыщенные и перенасыщенные растворы. О» Способы выражения состава растворов: массовая доля, молярная концентрация.
Арены. Номенклатура, изомерия. Ароматичность, правило Хюккеля. Полициклические ароматические системы. Методы получения бензола и его гомологов. Реакции электрофильного замещения в ароматическом кольце SeAr, общие закономерности и . механизм.
Внеклассная работа по химии в средней школе, ее принципы формы и направления
Электролитическая диссоциащп комплексных соединений. Константа нестойкости. Образование и разрушение комплексных ионов в растворах. Кислотно-основные свойства комплексных соединений Объяснение амфотерности гидроксидов с точки зрения комплексообразования и протонной теории.
Гетероциклические соединения, классификация и номенклатура. Пятичленные и шестичленными гетероциклы с одним и двумя гетероатомами, их ароматичность, основные химические свойства (на примере гетероциклов с одним гетероатомом). Гетероциклы в составе природных соединений.
Индивидуальный и дифференцированный подходы к учащимся в процессе обучения.
Состав и строение молекул воды. Полярность молекул. Водородная связь и ассоциация молекул воды. Аномалии воды, их объяснение. Роль воды в биологических процессах. Электролитическая диссоциация воды. Ионное произведение воды, рН среды. Индикаторы. Буферные растворы.
ДНК. Нуклеотидный состав и структура ДНК. Работы Э. Чергаффа, Д. Уотсона и Ф. Крика. Физико-химические свойства и молекулярная масса ДНК.
Методика формирования основных химических понятий. Этапы. Пути перехода от незнания к знанию. Развитие основных химических понятий.
Понятие о внутренней энергии системы и энтальпии. Теплота реакции, ее термодинамические и термохимические обозначения. Закон Гесса и следствия из него.
Белки. Первичная структура. Биологическое значение аминокислотной и последовательности. Расшифровка первичной структуры белков. Структурные уровни в архитектуре и пространственной организации белков.
Химический язык в школе. Структура. Значение формирования знаний химического языка.
Окисчительно-восстановителып i. реакции (ОВР), их классификация и методы расстановки коэффициентов. Роль среды в протекании ОВР (на примерах соединений марганца и хрома).
Стандартные ред-окс потенциалы. Направленность окислительно-восстановительных реакций
Карбоновые кислоты. Номенклатура. Факторы, влияющие на кислотность. Физико — химические свойства и методы получения кислот.
Политехнизация знаний по химии. Профориентация учащихся при обучении химии.
Общая характеристика разбавленных растворов неэлектролитов. Свойства растворов (давление насыщенного пара над раствором, эбулиоскопия и криоскопия, осмос). Роль осмоса в биологических процессах.
Производные карбоновых кислот: соли, галогенангидриды, ангидриды, эфиры, амиды и их взаимные переходы. Механизм реакции этерификации.
Алкины. Изомерия и номенклатура. Получение, химические свойства и применение алкинов.
Формирование научного мировоззрения учащихся при изучении химии в средней школе,
Основные типы химической связи. Ковалентная связь, ее свойства и основные характеристики. Квантово-механический метод ее трактовки. Метод валентных связей. Межмолекулярные взаимодействия.
Аминокислоты, строение, номенклатура, синтез и химические свойства.
Методы обучения химии. Их классификация. Развивающие функции.
Ионная связь, ее особенности. Ионные кристаллические решетки и свойства веществ с ионной кристаллической решеткой. Поляризация и поляризующее действие ионов, их влияние на свойства веществ.
Фенолы. методы получения. Химические свойства кислотность (влияние заместителей), реакции по гидроксильнои группе и ароматическому колы
Лекционно-семинарская система занятий по химии. Характеристика структурных элементов системы.
Общая характеристика и электронное строение атомов элементов V группы главной подгруппы. Аммиак, строение молекул, получение и свойства.
Альдегиды, кетоны и карбоновые кислоты ароматического ряда. Способы получения и химические свойства.
Уроки обобщения знаний и умений учащихся. Их особенности. Классификация. Пути систематизации знаний по химии на уроках обобщения.
Кислоты, основания и соли с точки зрения теории электролитической диссоциации. Амфотерные электролиты. Протонная теория кислот и оснований Бренстеда и Лоури.
Полисахариды. Крахмал и гликоген, их строение. Целлюлоза, строение и свойства. Химическая переработка целлюлочы и применение её производных.
Принципы обучения химии.
Обратимые и необратимые реакции. Условия наступления химического равновесия. Константа химического равновесия. Принцип Ле Шателье-Брауна и его применение.
а-Аминокислоты, классификация, стереохимия, кислотно-основные свойства, особенности химического поведения. Пептиды, пептидная связь. Разделение аминокислот и пептидов.
Особенности урока химии как основной организационной формы обучения. Типы уроков. Классификация уроков изучения новых знаний, и факторы, определяющие качество этих уроков.
Квантово-механическая модель строения атома. Квантовые числа, их физический смысл. Понятие об электронном облаке. Принципы заполнения атомных орбиталей. Символьная и графическая формы записи электронных формул.
Общая характеристика класса липидов. Простые и сложные липиды, их биологическая роль. Представление о метаболизме липидов.
Структура основных химических понятий. Их формирование и развитие на протяжении , изучения курса химии средней школы.
Связь местонахождения элемента в периодической системе с электронной структурой его атома. Периодичность изменения свойств элементов как отражение периодичности их изменения электронных конфигураций атомов. Сходство и различие в свойствах элементов главных и побочных подгрупп (на примерах серы и хрома, хлора и марганца)
Ферменты, их строение, номенклатура и классификация, принципы действия. Основы и ферментативной кинетики. Свойства ферментов. Активаторы и ингибиторы ферментов. Регуляция активности ферментов.
Наглядность в обучении химии. Виды наглядности и методы ее использования на уроках химии.
Металлы, их местонахождение в периодической системе. Металлическая связь. Общие физические и химические свойства металлов. Понятие о гальваническом элементе. Коррозия металлов и способы защиты металлов от коррозии. Электролиз расплавов и растворов.
Биосинтез белка. Этапы белкового синтеза и компоненты для его осуществления. Строение рибосом и их роль в биосинтезе белка. Механизм трансляции.
Химический кабинет в школе. Его организация и правила техники безопасности при работе.
Общая характеристика и электронное строение атомов элементов IV группы главной подгруппы. Углерод, аллотропные модификации углерода. Кислородные соединения углерода, их получение и строение молекул.
РНК. Типы РНК. Первичная, вторичная и третичная структура РНК. Роль тРНК в биосинтезе белка.
Пути развития мышления учащихся при изучении химии в средней школе.
Понятие о катализе. Катализ гомогенный и гетерогенный. Теории катализа. Биокатализ и биокатализаторы.
Одноатомные и многоатомные спирты, номенклатура, изомерия, способы получения. Физические, химические и медико-биологические свойства.
Демонстрационный эксперимент е обучении химии. Требования к нему. Формирование умений учащихся наблюдать и анализировать демонстрационные опыты.
Комплексные соединения: строение, природа химической связи, классификация, номенклатура.
Экспериментальные (качественные) задачи по химии. Их классификация. Этапы формирования умений учащихся решать экспериментальные (качественные) задачи по химии.
Азотная кислота: строение молекул, получение, физические и химические свойства (реакции с металлами и неметаллами, разбавленной и концентрированной азотной кислотой).
Моносахариды. Классификация, стереохимия, таутомерия. Методы получения и химические свойства. Важнейшие представители моносахаридов и их биологическая роль.
Подготовка учителя к уроку. Виды планирования. Рабочий план урока. Структура рабочего плана и его содержание. Роль и виды дидактических материалов к уроку
Оценка возможности протекания химической реакции в заданном направлении. Понятие об энтропии и изобарно-изотермическом потенциале. Максимальная работа процесса. Роль энтальпийного и энтропийного факторов.
Дисахариды, их типы, классификация. Различия в химических свойствах. Мутороация. Инверсия сахарозы. Биологическое значение дисахардов.
Массовая внеклассная работа по химии. Виды и организация массовых внеклассных мероприятий по химии.
Растворы электролитов. Причины и механизм электролитической диссоциации. Гидратация ионов. Основные положения теории электролитической диссоциации. Степень диссоциации. Константа диссоциации. Изотонический коэффициент.
Альдегиды и кетоны, изомерия и номенклатура. Сравнительная реакционная способность альдегидов и кетонов. Способы получения и химические свойства.
Самостоятельная работа учащихся по химии. Классификация самостоятельных работ, характеристика различных видов самостоятельных работ, их развивающие возможности.
Основные характеристики атомов: атомные радиусы, энергии ионизации, сродство к электрону, электроотрицательность, относительная электроотрицательность, их изменение с ростом заряда ядер атомов. Вопросы, поставленные периодическим законом и периодической системой, их решение с точки зрения представлений о строении атома. Современная формулировка периодического закона.
Алкены. Изомерия и номенклатура. Электронное строение алкенов. Способы получения к химические свойства. Полимеризация.
Задачи курса химии средней школы
Скорость химических реакций. Факторы, влияющие на скорость химической реакции. Классификация химических реакций. Молекулярность и порядок реакции. Энергия активации.
Алканы. Изомерия. Номенклатура. Методы синтеза. Физические и химические свойства алканов. Реакции радикального замещения Sr. Радикальное галогенирование алканов. Галогеналканы, химические свойства и применение.
Технические средства обучения и особенности их использования в преподавании химии.
Дисперсные системы, их классификация. Коллоидные растворы и их основные свойства: кинетическне, оптические, электрические. Строение коллоидных частиц. Значение коллоидов в биологии.
Алкадиены. Классификация, номенклатура, изомерия, электронное строение. Методы синтеза и химические свойства. Полимеризация. Понятие о изопреноидах. Натуральный и синтетический каучуки.
Лабораторные и практические занятия по химии: требования к выполнению и оформлению, их оценка.
Общая характеристика и электронное строение атомов элементов VI группы главной подгруппы. Серная кислота, ее получение. Свойства разбавленной и концентрированной серной кислоты (реакции с металлами и неметаллами).
Структура нуклеозидов и нуклеотидов. Нуклеозиды и трифосфаты. Динуклеотиды. НАД, НАДФ и ФАД, их биологические функции.
Проверка знаний и умений учащихся по химии: ее значение, требования, формы, виды и методы.
Основные химические понятия: относительная атомная и молекулярная масса, моль, молярный объем, число Авогадро. Основные законы химии, границы их применимости.
Амины, классификация, изомерия, номенклатура. Методы получения алифатических и ароматических аминов, их основность и химические свойства.
1. Расчетные химические задачи, их типы, овладение уч-ся по годам. Методические приемы формирования у уч-ся умения решать расчетные задачи по химии.
Хим. задачи помогают соверш-ю качества обучения уч-ся, закреплению приобр. знаний, форм-я умения, переносу их в новые ситуации, установлению межпредметных связей. Содействуют приобр. практич. умений и навыков уч-ся (производить расчеты и опыты), служат важным средством развития мышления уч-ся.
Клас-ция хим. задач: 1) качественные (на наблюдение, получение, док-ва отношения в-ва к группе, распознав. в-в, разделение смеси в-в, на конструирование приборов) 8-11 кл.
2) расчетные: * по хим. формулам (Вычисление Mr, массовой доли эл-тов в сл. в-ве, химического кол-ва в-ва по объему по массе, вычисление Mr по относит плотности, масса р-ра и раств. в-ва по массовой доле); по хим. уравнениям ( по известной массе одного из в-в, вычисление объема газа, расчет объемных отношений, по термохим. уравн., р-ции в р-рах, по избытку одного из в-в, примеси); * задачи на выведение формулы ( по массовым долям по колич. и кач. анализу орг. соед.). Классы см. в программке.
Общие метод. приемы по решению задач: кач-во теор. знаний (хим. св-в, способов получения и т.д.); умения проводить анализ условия задач, записывать краткое условие, отметить известные и неизвестные величины, продумать логическую цепочку в решении задачи; составление условий прямых и обратных задач; использование алгоритмов решения типовых задач, использовать наглядность по-возможности, исп. индивид и диф. подхода к уч-ся, исп-е единого образца оформления задач.
2. Растворы
-это гомогенные(однородные) системы переменного состава, состоящие из двух и более компанентов.*10-8 размеры частиц в растворах.*В зависимости от агрегатного состояния р-ры могут быть: твердыми, жидкими, газообразными.
Вкатодном р-ре имеется растворенное в-во и растворитель(это в-во),кот. в чистом виде нах-ся в такой же фазе,что и раствор.(кого больше-тот растворитель).
Мех-зм процесса растворения:
разрушаются связи или силы ММВ в исходных в-вах(эндотермический пр.,Qразр.<0 (∆H>0)).
возникают силы взаимодействия между растворенным в-вом и раствор-м(экзотермический пр.,Qгидрат.>0 (∆H<0)).
В воде(полярн.раствор-ль) будут растворяться в-ва:
с ионной кристалл. решеткой
полярные молекулы
молекулы,связанные водородной св.
Общий тепловой эффект процессов растворения Qраств.=Qразр.+Qгидр.(Н2SO4)>0,т.к.Qразр.<<Qгидр. Гидраты,нестойкие соединения и при нагревании они разлагаются, но иногда гидраты настолько прочны, что при выделении раствор-го в-ва из р-ра Н2О входит в состав его кристаллов(наз.кристаллогидраты),а вода- кристаллизац-й. Способность в-ва переходить в р-р,т.е. растворяться,наз-ся растворимостью. Мерой раств-ти в-ва при данных условиях, является масса в-ва в насыщенном р-ре.Насыщенный р-р, в кот. при данной t сущ-т динамическое равновесие между нераств.частью в-ва и в-вом в раствор-м состоянии. Количественной хар-кой раств-ти явл. молярная конц-я насыщенного р-ра(моль/л) или массовая доля растворенного в-ва в насыщенном р-ре.
Кs= (коэф.раств-ти), кот. показывает массу в-ва, кот. может раств-ся в 100г растворителя(Н2О).
Ненасыщенный р-р-это р-р, в кот. может быть раств-но еще некоторое кол-во растворенного в-ва при данной t.
Пересышенный р-р-при данной t раств-го в-ва содержится больше, чем в насыщенном р-ре. Неустойчивы эти р-ры,даже от сотрясения может выпасть избыток растворенного в-ва. Эти р-ры примен-ся для очистки в-в в перекристаллизации.
СПОСОБЫ ВЫРАЖЕНИЯ СОДЕРЖАНИЯ В-ВА В Р-РАХ:
массовая доля раств-го в-ва (W): W=m(в-ва)/m(р-ра)*100%
массовая концентрация(ρ): ρ=m(в-ва)/V(р-ра)
молярная концентрация: С(в-ва)=n(в-ва)⁄V(в-ва)
моляльность(ß):ß(в-ва)=n(в-ва)⁄m(р-ля)
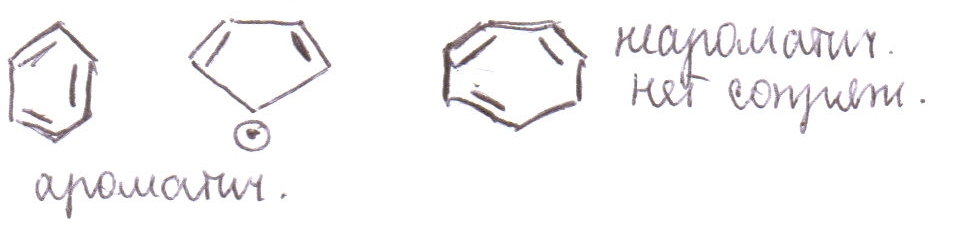
3. Арены. Понятие об ароматичности.
1 подход: отнесли соединения, обладающие ароматом
![]()
2 подход: относили соединения, содержащие бензойные кольца. На данном уровне Кекуле и Бутлеров внесли вклад по строению бензола. В то время знали, что по строению – это ненасыщенные соединения, т.е.кол-во водорода не максимально, и в то же время для них не были характерны реакции присоединения. Почему? Было предложено считать, что в бензоле и его аналогах электронная плотность 3х π связей делокализована. Это можно показать в виде резонансных структур, либо нарисовать обобщенную формулу
![]()
3 подход: правило Хюккеля ароматичными являются соединения, содержащие плоские замкнутые системы сопряженных π связей и/или неподеленных электронных пар и свободные орбитали, число ē-ов, кот. N=4n+2, где n=0, 1, 2, и т.д. Соединения с аналогичными системами, где N=4n, являются антиароматичными.

Номенклатура аренов. В основе названия циклических систем лежат тривиальные названия
I Моноциклические арены
![]()
II Би- и полициклические арены: с изолированными циклами
![]()
С конденсированными циклами
![]()
Номенклатура замещенных бензолов и их аналогов
1-й случай: если боковая цепь имеет сложное строение, то она выбирается главной. Бензойная система тогда выступает в качестве заместителя с тривиальным названием фенил (нафтил, антроцил)
2-й случай: в остальных случаях в качестве главной цепи выбирается бензойная система, при этом ряд функционально замещенных бензолов имеет тривиальные названия
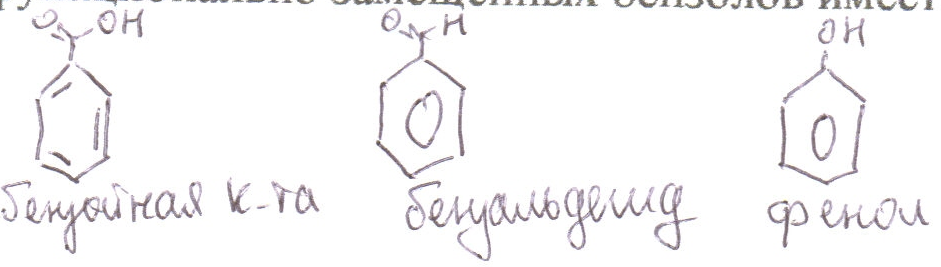
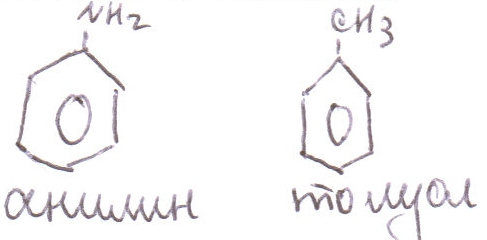
При введении дополнительных заместителей, последние выступают в названии всегда в качестве заместителей, при этом при этом при наличии функциональной группы, определяющей название класса, нумерация начинается от атома С, связанного с этой группой.
3-амино-4-нитро-5-метилбензальдегиж
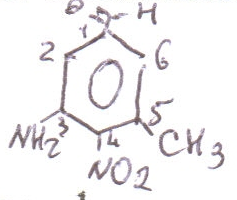
При наличии только 2-х заместителей, их положение можно назвать с помощью префиксов «о» - орто- рядом, «м» - мета- через один атом С, «п» - пара – через два атома С.
1,4-диметилбензл
n-диметилбензол
n-кслило
Химические свойства
реакции функциональных групп (f) – аналогичны реакциям соответствующих неароматических соединений.
реакции боковой (углеродной) цепи – аналогичны свойствам алканов и реакциям тех функциональных групп, которые содержатся в боковой цепи.
Реакции ароматического кольца.
2) Реакции боковой цепи: характерны реакции радикального замещения α-атома С
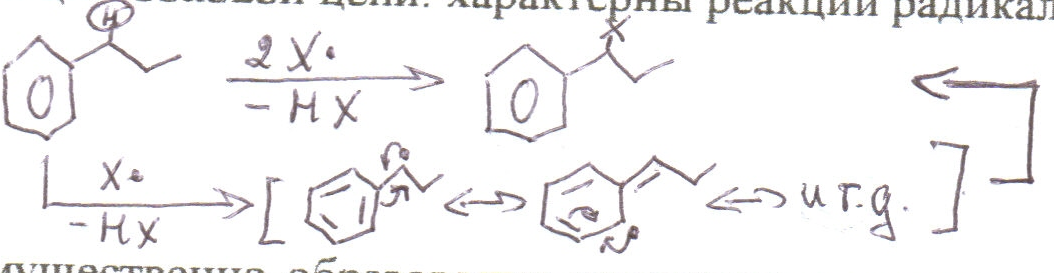
преимущественно образование продуктов α-замещения объясняется повышенной стабильностью соответствующего промежуточного бензильного радикала за счет делокализации ē с участием Ph
![]()
Реакции ароматического кольца. 1.Реакции с образованием неароматических продуктов. Ароматичность выгодна, данные процессы протекают в жестких условиях

Данные процессы протекают в более мягких условиях для конденсированных аналогов бензола
2. Реакции с образованием ароматических продуктов. Для аренов характерны реакции замещения водорода, которые протекают с участием Е и Nu
а) реакции эдектрофильного замещения (SEAr) происходит по механизму присоединения-отщепления
Электрофильное замещение в ряду монозамещенных бензолов
Электроно-доноры (D): alk; -OR, -NR2, -SR; -Hal.
Электронно-акцептор (А): -CF3; -C=N; -C-X; -NO2; -SO3H
Заместители влияют на скорость и направление процесса.
Элекронодонорные заместители (кроме Hal) ускоряют, а электроноакцепторные – замедляют процесс электрофильного замещения.
Влияние на направление процесса:
Если 2-я стадия обратима, то обратимой является вся реакция (это только алкилирование и сульфирование в жестких условиях).
При установлении равновесия соотношение продуктов реакции определяется их относительной стабильностью. М > П > О
Если 2-я стадия необратима, то с учетом того, что она очень быстрая соотношение продуктов реакции соответствует соотношению σ-комплексов.
Поскольку переходное состояние похоже на σ-комплекс, факторы влияющие на их состояние аналогичны => более стабильный σ-комплекс соответствует более стабильному переходному состоянию и более стабильный σ-комплекс образуется быстрее.
Факторы стабилизации σ-комплекса:
электронный: в случае D более стабильным является о- и п- σ-комплексы за счет участия в делокализации заместителя.
Стерический: при наличии объемных и/или полярных заместителей более стабильными являются м- и п- σ-комплексы.
В случае А все наоборот.
И в соотсетствии с ē-ым фактором D заместители являются о- и п-ориентантами, а А заместители м-ориентантами.
SEAr дизамещенных бензолов : согласованная ориентация
Несогласованная ориентация: т.к. D ускоряют, а А замедляют процесс, то при несогласованной ориентации учитывают влияние D заместителя
