
- •1. Аналитическая атомная спектроскопия
- •1.1. Метод эмиссионной фотометрии пламени
- •1.1.1. Физические основы
- •1.1.2. Аппаратурное оформление
- •1.1.3. Аналитические возможности
- •Работа №1. Определение натрия и калия при совместном присутствии способом градуировочного графика
- •Работа №2. Определение натрия и калия в минеральной воде способом ограничивающих растворов
- •1.2. Пламенный атомно-абсорбционный метод анализа
- •1.2.1. Физические основы
- •1.2.2. Аппаратурное оформление
- •1.2.3. Аналитические возможности
- •Работа №3. Определение меди в природной воде способом градуировочного графика
- •1.3. Рентгенофлуоресцентный метод анализа
- •1.3.1. Физические основы
- •1.3.2. Аппаратурное оформление
- •1.3.3. Аналитические возможности
- •Работа №4. Качественный анализ образца латуни
- •Работа №5. Определение примесей в образце стали способом градуировочного графика
- •2. Аналитическая молекулярная спектроскопия
- •2.1. Спектрофотометрический метод анализа
- •2.1.1. Физические основы
- •2.1.2. Аппаратурное оформление
- •2.1.3. Аналитические возможности
- •Работа №6. Определение никеля в виде комплекса с диметилглиоксимом в присутствии окислителей
- •Работа №7. Определение хрома в виде комплекса с дифенилкарбазоном
- •Работа №8. Определение аналитической концентрации метилового оранжевого в растворах различной кислотности
- •Работа №9. Определение константы кислотной диссоциации фенолового красного (фенолсульфофталеина)
- •2.2. Флуориметрический метод анализа
- •2.2.1. Физические основы
- •2.2.2. Аппаратурное оформление
- •2.2.3. Аналитические возможности
- •Работа №10. Проверка правила зеркальной симметрии спектров поглощения и флуоресценции рибофлавина
- •Работа №11. Определение рибофлавина в инъекционном растворе способом градуировочного графика
- •7. Спектральное оборудование для выполнения практических работ
- •7.1. Пламенный фотометр Jenway pfp7
- •7.1.1. Технические характеристики
- •7.1.2. Порядок работы
- •Капилляр для подачи жидкой пробы в пламя газовой горелки должен быть погружён в химический стакан ёмкостью 100 – 150 мл с дистиллированной водой.
- •7.2. Пламенный спектрофотометр квант-2а
- •7.2.1. Технические характеристики
- •7.2.2. Порядок работы
- •7.3. Рентгенофлуоресцентный спектрометр Спектроскан макс-gf2e
- •7.3.1. Технические характеристики
- •7.3.2. Порядок работы
- •7.4. Нерегистрирующий спектрофотометр Leki ss1207
- •7.4.1. Технические характеристики
- •7.4.2. Порядок работы
- •7.5. Регистрирующий спектрофотометр unico uv-2804
- •7.5.1. Технические характеристики
- •7.5.2. Порядок работы
- •7.6. Спектрофлуориметр Флюорат-02-Панорама
- •7.6.1. Технические характеристики
- •7.6.2. Порядок работы
Работа №11. Определение рибофлавина в инъекционном растворе способом градуировочного графика
Для проведения количественного флуориметрического анализа необходимо установить функциональную связь между интенсивностью флуоресценции раствора люминофора (Iфл.) и его концентрацией (c). Допустим, что аналитический сигнал формирует истинный нерассеивающий раствор, помещённый в кубическую кювету с длиной ребра l. Расположим кювету в прямоугольной системе координат (x, y, z). Плоскопараллельный пучок первичного излучения с длиной волны 0 интенсивностью I0 проходит сквозь кювету вдоль оси x. Вторичное излучение люминофора с длиной волны фл. отбирается под прямым углом к потоку возбуждающего света вдоль оси y. На расстоянии x от стенки кюветы интенсивность флуоресцентного излучения испущенного элементарным объёмом раствора dV=dxdydz пропорциональна
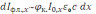
где к. – квантовый выход флуоресценции, 0 – коэффициент поглощения первичного излучения люминофором. При прохождении сквозь раствор интенсивность первичного излучения уменьшается за счёт поглощения молекулами люминофора и сопутствующими компонентами (эффект внутреннего фильтра). По закону Бугера – Ламберта:
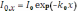
где k0 – коэффициент экстинкции раствора для первичного излучения. Этот коэффициент, по закону Бера, пропорционален концентрации поглощающих частиц (ci). Принимая во внимание закон Фирордта:
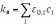
где 0,i – коэффициент поглощения возбуждающего излучения i-м компонентом. Возникшее в элементарном объёме раствора dV флуоресцентное излучение ослабляется в направлении детектора при прохождении через слой раствора толщиной y, вследствие поглощения молекулами люминофора и сопутствующими компонентами (эффект реабсорбции):
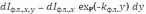
где kфл. – коэффициент экстинкции раствора для вторичного излучения
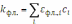
а фл.,i – коэффициент поглощения флуоресцентного излучения i-м компонентом. Полную интенсивность вторичного излучения можно получить, интегрируя по всему объёму раствора люминофора:
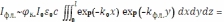

Используя основной закон поглощения света и базовые соотношения для оптической плотности (A) и пропускания (T) раствора, данное выражение можно переписать следующим образом:
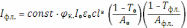
Константа в правой части уравнения учитывает, в первую очередь, аппаратные факторы – долю флуоресцентного излучения, попавшего в монохроматор, пропускание спектрометра, эффективность детектирования и др.
Если раствор люминофора слабо поглощает первичное и вторичное излучение и k0l и kфл.l < 0,05 , т.е. эффекты внутреннего фильтра и реабсорбции практически не выражены, формула для интенсивности флуоресцентного излучения значительно упрощается:
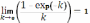
поэтому
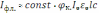
Цель данной работы – флуориметрическое определение содержания рибофлавина в инъекционном растворе. Для выполнения работы необходимо выбрать длины волн первичного и вторичного излучений, построить градуировочный график и с его помощью определить содержание рибофлавина в анализируемом растворе.
Реагенты, аппаратура, посуда
Стандартный раствор рибофлавина 10 мкг/мл.
Раствор рибофлавина мононуклеотида в инъекциях (ампулы).
Спектрофлуориметр «Флюорат-02-Панорама».
Кварцевые кюветы, l = 1 см.
Мерные колбы ёмкостью 25,0.
Пипетки, 1,00; 2,00 и 5,00 мл.
Выполнение определения
На основании спектров поглощения и флуоресценции, измеренных в предыдущей работе выбирают оптимальные длины волн возбуждения и измерения интенсивности флуоресценции. В пяти мерных колбах ёмкостью 25,0 мл готовят серию растворов рибофлавина с содержанием (мкг/мл): 0,2; 0,4; 0,6; 0,8 и 1,0. Следует уделить особое внимание чистоте используемой посуды и кювет. Мерные колбы тщательно промывают раствором соды, а кюветы концентрированной соляной кислотой (под тягой), после чего многократно ополаскивают их водопроводной и два раза дистиллированной водой. Измеряют интенсивность флуоресценции контрольного опыта (дистиллированная вода) и растворов стандартной серии в порядке увеличения концентрации люминофора (длина оптического пути – 1 см). По полученным данным строят градуировочный график в координатах интенсивность флуоресценции – концентрация рибофлавина, мкг/мл. Анализируемый инъекционный раствор в мерной колбе ёмкостью 25,0 мл разбавляют до метки дистиллированной водой и тщательно перемешивают. Содержание рибофлавина в анализируемом растворе находят по градуировочному графику, измерив интенсивность его флуоресценции. В заключение проводят 10 измерений интенсивности флуоресценции раствора контрольного опыта и рассчитывают предел обнаружения (сmin) методики определения рибофлавина по 3s-критерию:
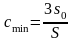 ,
,
где s0 – стандартное отклонение результатов контрольного опыта (n = 10), S – среднее значение крутизны градуировочного графика. Величину предела обнаружения выражают в мкг/мл и моль/л.
Вопросы для подготовки к коллоквиуму
|
|
1. |
Укажите особенности молекулярной структуры (электронного строения) органических (неорганических) люминофоров.
|
2. |
Что такое спектры возбуждения и флуоресценции? Дайте определение.
|
3. |
В чём состоят основные различия между двумя видами молекулярной люминесценции – флуоресценцией и фосфоресценцией?
|
4. |
На одном рисунке изобразите спектры поглощения, флуоресценции и фосфоресценции одного и того же люминофора. Объясните их взаимное расположение при помощи диаграмм Яблонского.
|
5. |
Какая область спектра флуоресценции – коротковолновая или длинноволновая – подвержена наибольшим искажениям вследствие самопоглощения (реабсорбции). Ответ поясните графически.
|
6. |
Какую информацию может извлечь химик-аналитик из спектров возбуждения (поглощения) и флуоресценции при разработке методики определения люминофора в растворе?
|
7. |
Зависит ли форма спектра флуоресценции от энергии возбуждающего излучения? Обоснуйте ответ.
|
8. |
Приведите уравнение, связывающее квантовый и энергетический выходы люминесценции. Какая из указанных величин больше? Поясните физический смысл полученного математического выражения.
|
9. |
Перечислите основные требования, предъявляемые к источнику излучения в молекулярной люминесцентной спектроскопии.
|
10. |
В каком методе анализа – спектрофотометрическом или люминесцентном – флуктуации интенсивности источника излучения сильнее сказываются на погрешности измерения аналитического сигнала?
|
11. |
Почему в люминесцентном анализе увеличение мощности источника излучения не всегда сопровождается пропорциональным ростом чувствительности определения люминофора? Какой фактор ограничивает чувствительность флуориметрических методик определения?
|
12. |
Сравните оптическую схему спектрофотометра и спектрофлуориметра. Почему интенсивность люминесценции, как правило, измеряют под углом 90 к направлению распространения возбуждающего излучения?
|
13. |
Что понимают под тушением люминесценции? Перечислите основные причины, вызывающие это явление.
|
14. |
Как и почему влияет температура на интенсивность молекулярной люминесценции?
|
15. |
Почему на спектрофлуориметрах без полноценного монохроматора возбуждающего излучения устанавливают абсорбционные светофильтры, поглощающие длинноволновую часть спектра источника излучения?
|
16. |
Назовите причины нелинейных искажений градуировочной зависимости в люминесцентном анализе в области малых и больших концентраций.
|
17. |
Назовите способы повышения селективности флуориметрического метода.
|
18. |
Сравните и объясните различия аналитических возможностей люминесцентного и спектрофотометрического методов. |
Приложение
