
- •1. Аналитическая атомная спектроскопия
- •1.1. Метод эмиссионной фотометрии пламени
- •1.1.1. Физические основы
- •1.1.2. Аппаратурное оформление
- •1.1.3. Аналитические возможности
- •Работа №1. Определение натрия и калия при совместном присутствии способом градуировочного графика
- •Работа №2. Определение натрия и калия в минеральной воде способом ограничивающих растворов
- •1.2. Пламенный атомно-абсорбционный метод анализа
- •1.2.1. Физические основы
- •1.2.2. Аппаратурное оформление
- •1.2.3. Аналитические возможности
- •Работа №3. Определение меди в природной воде способом градуировочного графика
- •1.3. Рентгенофлуоресцентный метод анализа
- •1.3.1. Физические основы
- •1.3.2. Аппаратурное оформление
- •1.3.3. Аналитические возможности
- •Работа №4. Качественный анализ образца латуни
- •Работа №5. Определение примесей в образце стали способом градуировочного графика
- •2. Аналитическая молекулярная спектроскопия
- •2.1. Спектрофотометрический метод анализа
- •2.1.1. Физические основы
- •2.1.2. Аппаратурное оформление
- •2.1.3. Аналитические возможности
- •Работа №6. Определение никеля в виде комплекса с диметилглиоксимом в присутствии окислителей
- •Работа №7. Определение хрома в виде комплекса с дифенилкарбазоном
- •Работа №8. Определение аналитической концентрации метилового оранжевого в растворах различной кислотности
- •Работа №9. Определение константы кислотной диссоциации фенолового красного (фенолсульфофталеина)
- •2.2. Флуориметрический метод анализа
- •2.2.1. Физические основы
- •2.2.2. Аппаратурное оформление
- •2.2.3. Аналитические возможности
- •Работа №10. Проверка правила зеркальной симметрии спектров поглощения и флуоресценции рибофлавина
- •Работа №11. Определение рибофлавина в инъекционном растворе способом градуировочного графика
- •7. Спектральное оборудование для выполнения практических работ
- •7.1. Пламенный фотометр Jenway pfp7
- •7.1.1. Технические характеристики
- •7.1.2. Порядок работы
- •Капилляр для подачи жидкой пробы в пламя газовой горелки должен быть погружён в химический стакан ёмкостью 100 – 150 мл с дистиллированной водой.
- •7.2. Пламенный спектрофотометр квант-2а
- •7.2.1. Технические характеристики
- •7.2.2. Порядок работы
- •7.3. Рентгенофлуоресцентный спектрометр Спектроскан макс-gf2e
- •7.3.1. Технические характеристики
- •7.3.2. Порядок работы
- •7.4. Нерегистрирующий спектрофотометр Leki ss1207
- •7.4.1. Технические характеристики
- •7.4.2. Порядок работы
- •7.5. Регистрирующий спектрофотометр unico uv-2804
- •7.5.1. Технические характеристики
- •7.5.2. Порядок работы
- •7.6. Спектрофлуориметр Флюорат-02-Панорама
- •7.6.1. Технические характеристики
- •7.6.2. Порядок работы
Работа №9. Определение константы кислотной диссоциации фенолового красного (фенолсульфофталеина)
Метод спектрофотометрии широко используют для решения не только аналитических, но и исследовательских задач. Рассмотрим эту возможность на примере экспериментального нахождения константы диссоциации слабой органической кислоты в водном растворе.
По определению, реальная константа диссоциации кислоты HB равна:
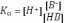
Значит, для вычисления этой константы необходимо найти концентрацию ионов водорода в растворе (т.е. измерить pH) и отношение концентраций депротонированной и протонированной формы кислоты. Если интересующая rислота поглощает излучение в оптическом диапазоне, то для решения этой задачи можно воспользоваться спектрофотометрическим методом. Рассмотрим наиболее общий случай, когда поглощать излучение с некой длиной волны способны обе формы кислоты. По закону аддитивности оптических плотностей:
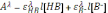
Индекс в дальнейшем для краткости опущен. Общая концентрация кислоты складывается из суммы равновесных концентраций обеих форм:
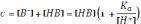
Следовательно, равновесная концентрация протонированной формы равна:
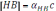
где
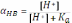
Отсюда,
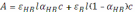
Поскольку
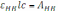 и
и 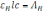
где AHB и AB – оптические плотности растворов, в которых кислота находится только в одной форме, перепишем эту формулу иначе:
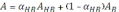
Следовательно,
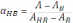
Отсюда,
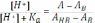
«Перевернём» эти дроби:
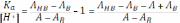
И в итоге получаем выражение для расчёта константы диссоциации:
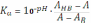
Пусть при длине волны измерения AHB > AB, тогда оптическая плотность смеси разных форм кислоты принадлежит интервалу [AB; AHB]. Для корректного вычисления разностей в числителе и знаменателе дроби они должны быть достаточно большими. Следовательно, рабочее значение длины волны нужно выбирать таким образом, чтобы разность молярных коэффициентов поглощения обеих форм кислоты была максимальной, с одной стороны. А с другой стороны, оптическая плотность рабочего раствора кислоты должна быть как можно ближе к середине указанного интервала. Требуемые значения оптической плотности лежат в интервале pKa 2, поскольку за его пределами в растворе присутствует лишь одна форма кислоты. Но так как границы этого интервала a priori неизвестны, следует приготовить большое число эквимолярных растворов кислоты в широком диапазоне pH (от 2 до 12).
Если протонированная и депротонированная форма органической кислоты имеет разную окраску, полосы поглощения этих форм удалены в спектре друг от друга, по крайней мере, на несколько десятков нанометров. Если представить спектры поглощения в одной системе координат, то будет хорошо видно, что по мере увеличения pH оптическая плотность в максимуме полосы поглощения для протонированной формы будет постепенно уменьшаться, и наоборот, оптическая плотность в максимуме полосы поглощения для депротонированной формы будет увеличиваться, достигнув в итоге наибольшего значения. Причём, если растворы приготовлены правильно, и ионная сила везде одинаковая, все спектры должны пересечься в изобестической точке. Это критерий качества приготовления эквимолярных растворов. В общем случае для выбора рабочей длины волны следует из спектра раствора, содержащего только протонированную форму кислоты, вычесть спектр раствора, содержащего только депротонированную форму, и найти максимум этой разности. При выбранной длине волны следует фотометрировать все растворы и найденные значения оптической плотности использовать для расчёта константы диссоциации. Результаты этих параллельных вычислений следует усреднить.
Для нахождения константы диссоциации также используют графический способ. Преобразуем расчётную формулу следующим образом:
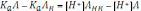
Отсюда,
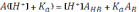
Следовательно,

Экспериментально измеренная зависимость оптической плотности раствора кислоты от pH имеет две асимптоты (AAB, AAHB) и точку перегиба:
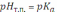 и
и 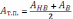
Для нахождения значения термодинамической константы диссоциации следует воспользоваться соотношением
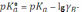
предварительно рассчитав коэффициент активности по формуле Дебая-Хюккеля, используя значение ионной силы I:
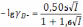
Цель настоящей работы – проверка возможности спектрофотометрического определения константы диссоциации на примере фенолового красного.
Водные растворы фенолового красного меняют окраску с жёлтой на красную при изменении pH с 6,4 до 8,2. Переход окраски обусловлен отщеплением второго протона от молекулы индикатора:
HA- ↔ A2- + H+
жёлтая красная
Полоса поглощения жёлтой формы располагается при 440 нм, а красной – при 570 нм. Исследуя спектры поглощения фенолового красного в слабокислых и слабощелочных средах, можно определить константу его кислотной диссоциации по второй ступени – Ka,2.
Реагенты и аппаратура
Феноловый красный, 0,25%-ный раствор в 50%-ном этаноле
Серия буферных растворов с pH: 5,02; 5,72; 6,80; 7,00; 7,24; 7,54; 7,96; 8,36 8,69; 8,95; 10,38; 10,88 (табл. 3)
Спектрофотометр UNICO UV-2804
Выполнение определения
В мерные колбы ёмкостью 50,0 мл помещают по 1,00 мл раствора фенолового красного и буферные смеси с соответствующими значениями pH. Содержимое колб разбавляют водой до метки и перемешивают. Затем последовательно измеряют pH всех приготовленных растворов, тщательно промывая стеклянный электрод между измерениями дистиллированной водой и удаляя избыток жидкости с «шарика» фильтровальной бумагой. Рабочие растворы необходимо помешать в чистые и сухие стеклянные стаканчики, а после измерения pH переливать обратно в колбы. Значение pH следует считывать с экрана не ранее, чем через 3 мин после погружения электрода в рабочий раствор и его периодического перемешивания. После измерения pH измеряют спектры поглощения всех растворов в интервале от 400 до 650 нм. Определив оптическую плотность каждого раствора в максимуме полосы поглощения одной из форм кислоты, находят значение константы диссоциации расчётным и графическим способом.
Вопросы для подготовки к коллоквиуму
|
|
1. |
Обоснуйте квазинепрерывную широкополосную структуру оптических молекулярных абсорбционных спектров. Перечислите способы повышения дискретности этих спектров.
|
2. |
Что такое раствор сравнения в спектрофотометрическом анализе? Каков его состав и назначение?
|
3. |
В чём различие между истинным и средним молярным коэффициентом поглощения? Почему экспериментально измеренные значения молярных коэффициентов поглощения могут отличаться от истинных?
|
4. |
Почему с ростом коэффициента поглощения чувствительность спектрофотометрического определения, как правило, увеличивается? Ответ поясните графически.
|
5. |
Почему чувствительность спектрофотометрического метода заметно ниже чувствительности атомно-абсорбционного метода?
|
6. |
Перечислите требования к органическому реагенту при проведении фотометрической реакции.
|
7. |
Можно ли существенно повысить чувствительность спектрофотометрического определения веществ увеличением толщины кюветы?
|
8. |
Как меняется вид градуировочной зависимости оптической плотности от концентрации с ростом интенсивности рассеянного излучения?
|
9. |
Зависит ли чувствительность спектрофотометрического определения от мощности источника излучения? Почему?
|
10. |
Укажите причины положительных и отрицательных отклонений от закона Бугера-Ламберта-Бера в области больших концентраций поглощающего вещества.
|
11. |
Почему рабочий диапазон оптических плотностей спектрофотометра не превышает 1,5 – 2 порядков?
|
12. |
Укажите и обоснуйте преимущества дифференциального спектрофотометрического метода по сравнению с абсолютным.
|
13. |
Изложите сущность процедуры градуирования измерительной шкалы прибора в методе абсолютной и дифференциальной спектрофотометрии.
|
14. |
При каких длинах волн следует измерять оптическую плотность растворов при спектрофотометрическом анализе смесей веществ, если их спектры поглощения накладываются друг на друга?
|
15. |
Как можно повысить селективность фотометрической методики?
|
16. |
Перечислите законы, используемые при выполнении спектрофотометрического анализа однокомпонентной системы, определении нескольких компонентов при совместном присутствии, нахождении константы химического равновесия в растворе.
|
17. |
Представьте графически и сравните зависимости поглощения, пропускания, оптической плотности и коэффициента поглощения на выбранной длине волны от концентрации поглощающего вещества в растворе и толщины используемой кюветы. |
