- •1. Классификация электрохимических методов анализа
- •2. Потенциометрия
- •2.1. Потенциометрическое титрование
- •2.1.1. Индикаторные электроды, преимущества потенциометрической индикации конечной точки титрования
- •2.1.2. Кислотно-основное титрование
- •2.1.3. Потенциометрическое титрование в неводных средах
- •2.1.4. Индикация конечной точки потенциометрического титрования
- •2.2. Прямая потенциометрия. Ионометрия.
- •2.2.1. Ионоселективные мембранные электроды и их классификация
- •2.2.2. Ионоселективные электроды с твердыми мембранами
- •2.2.3. Электроды с жесткой матрицей. Стеклянный электрод
- •2.2.4. Ионоселективные электроды с жидкими мембранами
- •2.2.5. Газочувствительные электроды
- •2.2.6. Потенциометрические биосенсоры
- •2.2.7. Ионоселективные полевые транзисторы
- •2.2.8. Ионоселективные микроэлектроды
- •3. Электрогравиметрия и кулонометрия
- •3.1. Законы электролиза
- •3.2. Электрогравиометрический анализ
- •3.3. Кулонометрия
- •3.3.1. Классификация кулометрических методов
- •3.3.2. Прямая потенциостатическая кулонометрия
- •3.3.3. Прямая амперостатическая кулонометрия
- •3.3.4. Кулонометрическое титрование при постоянной силе тока
- •15.6. Электрогенерирование кулонометрических титрантов в неводных средах
2.2.3. Электроды с жесткой матрицей. Стеклянный электрод
Широкое распространение средств измерений рН для различных целей обусловлено наличием удобных и разнообразных стеклянных электродов. По принципу действия стеклянный электрод относится к мембранным электродам типа
Ag, AgCl │HC1 (0,1 моль/л) │ стекло │ исследуемый раствор.
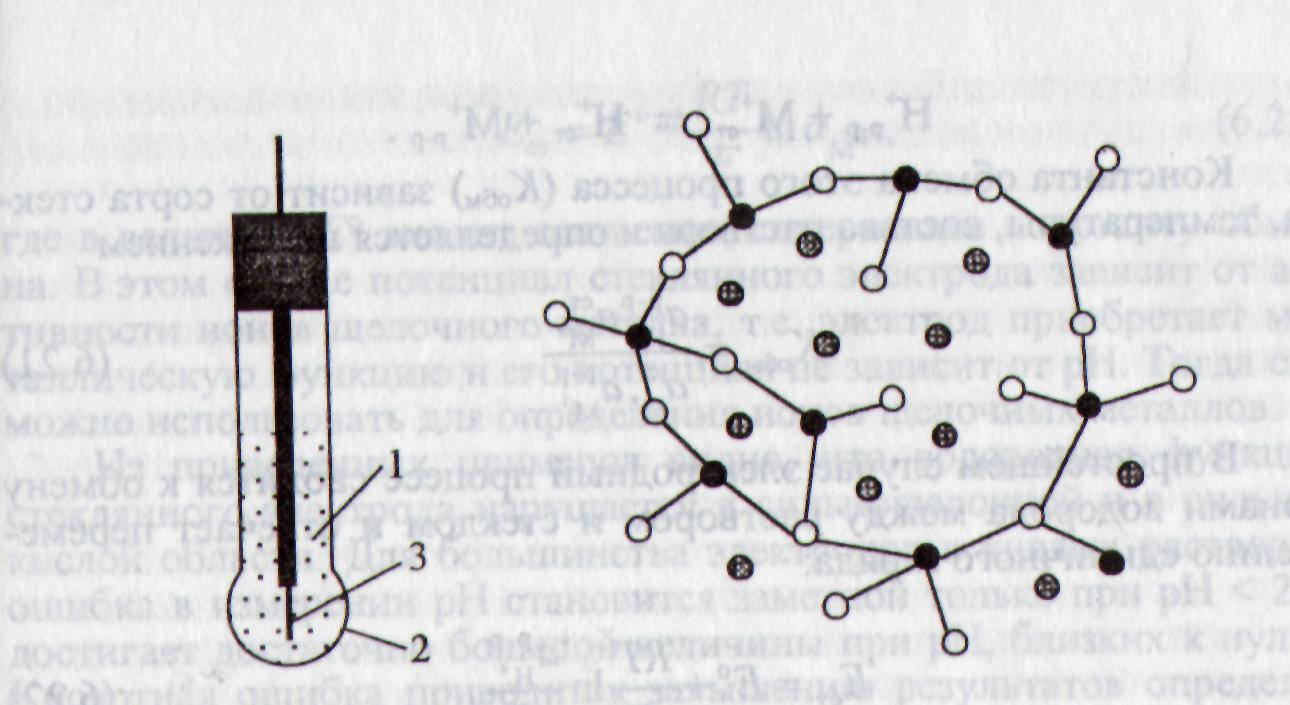
Его изготавливают в виде стеклянного шарика, внутри которого вмонтирован вспомогательный электрод (рис. 2.24). В качестве последнего применяют хлоридсеребряный, каломельный или хингидронный электроды в растворе соляной кислоты с постоянным значением рН или в буферном растворе.
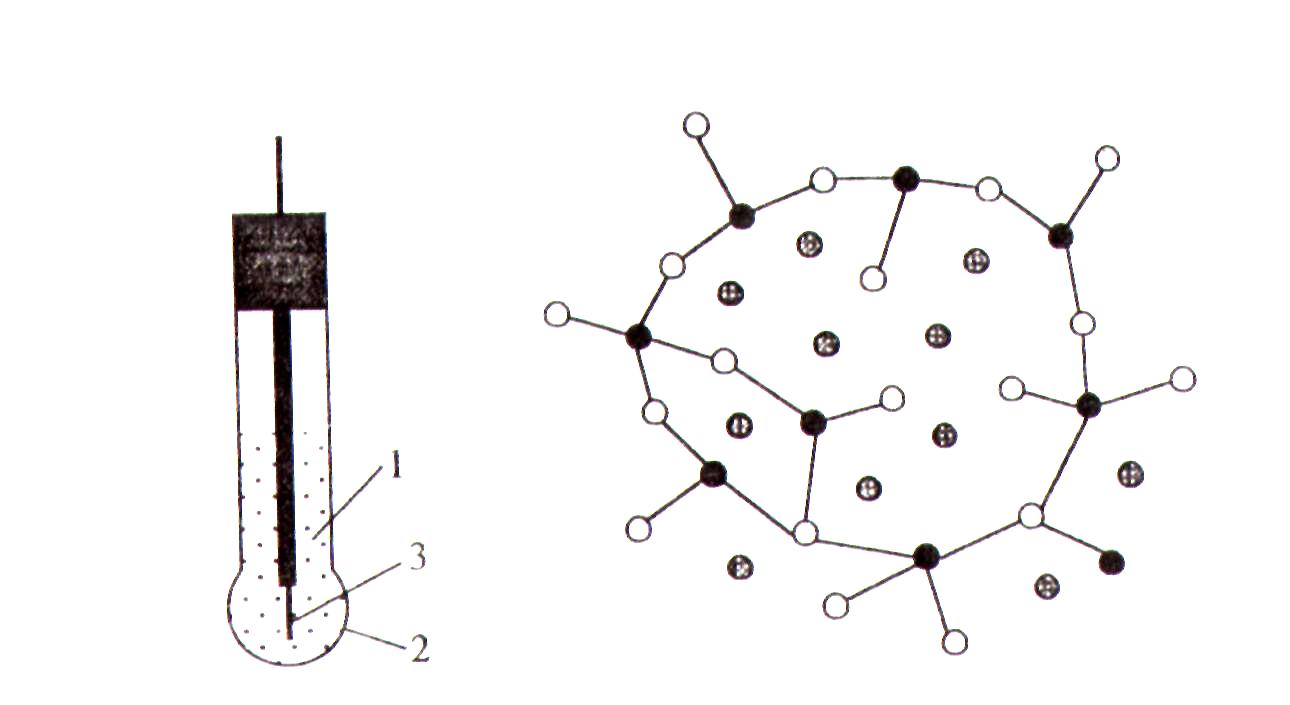
Большой вклад в развитие теории стеклянных электродов внесли работы Никольского. В настоящее время принято считать, что на поверхности стекла при длительном контакте мембраны с раствором молекулы воды проникают в нее на глубину 10 – 1000 Å, образуя гидратированный поверхностный слой, в котором протекают реакции ионного обмена между катионами щелочных металлов, входящими в состав силикатов, и ионами водорода. Основные структурные характеристики стекла в гидратированном слое не меняются, но подвижность катионов значительно увеличивается по сравнению с подвижностью в плотной внутренней части стеклянной мембраны. При этом транспорт катионов в гидратированном слое регулируется вакансионным механизмом, согласно которому вакансиями являются катионы в межузловых положениях трехмерного скелета, построенного из кремнийкислородных цепочек (рис. 2.25). При контакте с раствором они могут обмениваться на другие катионы, главным образом на ионы водорода:
Н+р-р + М+ст = Н+ст + М+р-р
Константа обмена этого процесса (Кобм) зависит от сорта стекла, состава раствора, температуры и определяется выражением
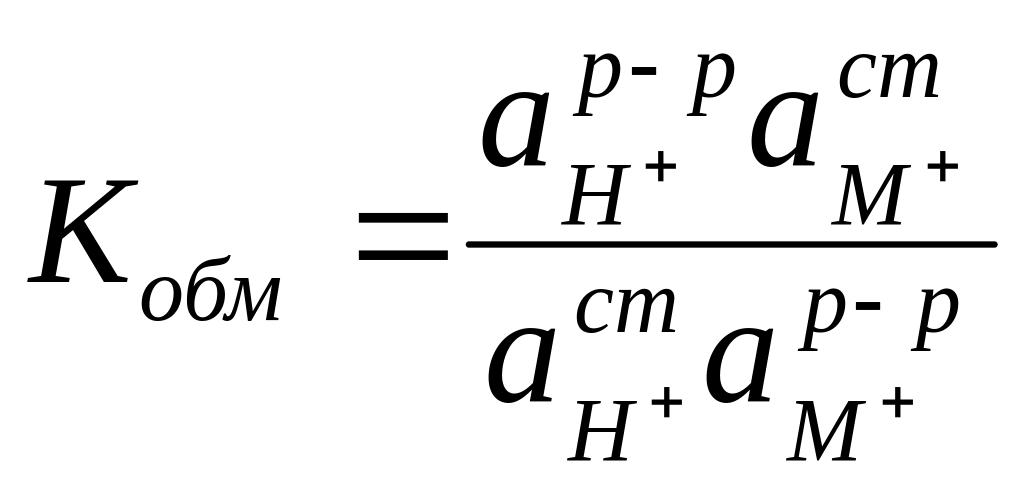 .
(2.96)
.
(2.96)
|
|
Рис. 2.24. Конструкция стеклянного электрода: 1- 0,1 моль/л HCl; 2 – стеклянная мембрана; 3 – Ag/AgCl |
Рис. 2.25. Структура стекла
● −Si;
○−кислород;
|
При контакте с раствором они могут обмениваться на другие катионы, главным образом на ионы водорода:
Н+р-р + М+ст = Н+ст + М+р-р
Константа обмена этого процесса (Кобм) зависит от сорта стекла, температуры, состава раствора и определяется выражением
. (2.97)
В простейшем случае электродный процесс сводится к обмену ионами водорода между раствором и стеклом и отвечает перемещению единичного заряда:
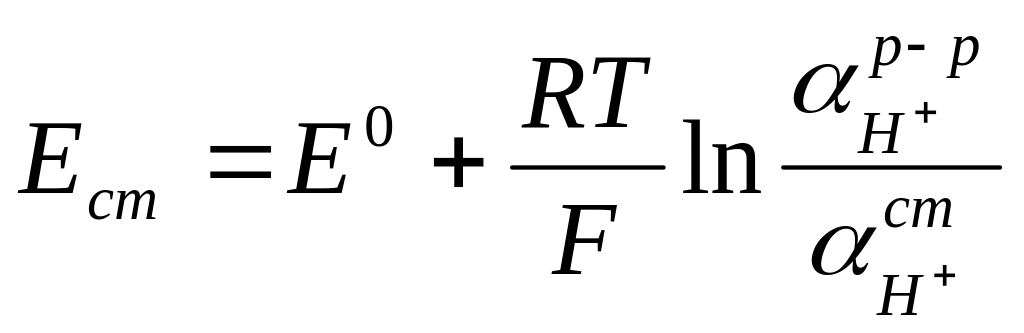 .
(2.98)
.
(2.98)
Член Е° включает в себя потенциал вспомогательного электрода, потенциал электрода сравнения и потенциалы жидкостных соединений, имеющихся в ячейке.
Если предположить, что сумма активностей ионов водорода и щелочного металла в стекле постоянна и выразить отношение активностей ионов в (2.98) через константу обмена, то получим выражение
![]() .
(2.99)
.
(2.99)
Из (2.99) следует, что потенциал стеклянного электрода в общем случае определяется активностью ионов водорода и щелочного металла в растворе. Если
aH+>>KобмаМ+,
что имеет место в случае кислых растворов, а также вследствие малой величины Кобм для нейтральных и слабощелочных сред, вплоть до рН 10-12, выражение (2.99) упрощается до
![]() .
(2.100)
.
(2.100)
Видно, что электродный потенциал зависит только от активности ионов водорода, и поэтому стеклянный электрод используется как для непосредственного определения рН, так и для фиксирования точки эквивалентности при кислотно-основном титровании.
Во втором случае, когда
aH+<<KобмаМ+,
т.е. в достаточно щелочной области, выражение (2.99) также упрощается и
![]() ,
(2.101)
,
(2.101)
где в величину Е° входит слагаемое, содержащее константу обмена. В этом случае потенциал стеклянного электрода зависит от активности ионов щелочного металла, т.е. электрод приобретает металлическую функцию и его потенциал не зависит от рН. Тогда его можно использовать для определения ионов щелочных металлов.
Из приведенных примеров видно, что водородная функция стеклянного электрода нарушается в сильнощелочной и в сильнокислой области. Для большинства электродов в кислых растворах ошибка в измерении рН становится заметной только при рН < 2 и достигает достаточно большой величины при рН, близких к нулю. Кислотная ошибка приводит к завышению результатов определения рН по сравнению с истинными. Ее природа до сих пор детально не выяснена. Одно из предположений состоит в том, что в кислой среде с высокой ионной силой активность воды по обеим сторонам стеклянной мембраны не остается одинаковой, и поэтому в воде возникает концентрационная ячейка, потенциал которой также входит в измеряемую разность потенциалов. Кислотные ошибки трудно устранить, но, к счастью, они невелики.
В щелочных средах при рН > 9 значения потенциалов ниже рассчитанных по уравнению Нернста. При дальнейшем увеличении рН ошибка возрастает. Так, при рН 12 для обычных стеклянных электродов она составляет -0,7 ед. рН в присутствии 1 моль/л ионов натрия и -0,3 ед. рН в присутствии 0,1 моль/л последних. Величину щелочной ошибки можно существенно снизить, если использовать стекла другого состава. Чем меньше радиус катиона щелочного металла в стекле, тем меньше конкурирующих катионов (помимо ионов водорода), способных его замещать, и тем выше должна быть их концентрация в растворе, чтобы они могли внедриться в стекло. В настоящее время разработаны литиевые стекла, щелочная ошибка которых в десятки раз меньше, чем у обычных электродов. Электроды из таких стекол можно использовать даже в растворах КОН или NaOH с концентрацией 0,1 моль/л.
Для измерения потенциала стеклянного электрода его включают в цепь с электродом сравнения и помещают в исследуемый раствор. Потенциал каждой из сторон стеклянной мембраны обусловлен соответствующими реакциями ионного обмена. На одной из них (внутренней) он остается постоянным, а на другой (внешней) зависит от состава раствора. Таким образом, потенциал стеклянного электрода представляет собой разность потенциалов между двумя поверхностями мембраны. Если бы они были идентичными, то для одного и того же раствора внутри электрода и с его внешней стороны потенциал должен был бы равняться нулю. Однако на практике для стеклянного электрода наблюдается некоторая разность потенциалов, называемая потенциалом асимметрии, которая входит в величину его гипотетического стандартного потенциала.
Возникновение потенциала асимметрии возможно при химических воздействиях на поверхность электрода (протравливание щелочами или плавиковой кислотой), механических повреждениях (стачивание, шлифование), адсорбции жиров, белков и других поверхностно-активных веществ. К наиболее важным причинам возникновения потенциала асимметрии относится изменение сорбционной способности стекла по отношению к воде при термической обработке в процессе изготовления электрода. Некоторый вклад вносит дегидратация набухшего поверхностного слоя (высушивание или выдерживание в дегидратирующем растворе). Возникновению потенциала асимметрии способствует неодинаковое напряжение на двух сторонах стеклянной мембраны. Если пустоты кремнийкислородной решетки на одной ее поверхности отличаются по форме от пустот на другой поверхности, то нарушается равновесие переноса ионов между стеклом и раствором и возникает потенциал асимметрии. В общем, любое воздействие, способное изменить состав или ионообменные свойства мембраны, влияет на потенциал асимметрии стеклянного электрода и может привести к ошибкам в измерениях рН. Мешающее действие потенциала асимметрии компенсируют при настройке рН-метров по стандартным буферным растворам, имеющим постоянную и точно известную концентрацию ионов водорода.
По сравнению с другими электродами, применяемыми для измерения рН растворов (водородный, хингидронный, сурьмяный и т.д.), стеклянный электрод имеет целый ряд преимуществ. Он пригоден для определения рН в области от 0 до 12. Электрод не чувствителен к окислителям и восстановителям, не отравляется, может работать в средах, содержащих катионы различных металлов. Равновесие между раствором и электродом устанавливается достаточно быстро. Кроме того, стеклянный электрод отличается высокой селективностью, поскольку радиус гидратированного протона существенно отличается от радиуса всех других ионов. Для фазового перехода протону необходима относительно малая энергия активации и, наконец, он может переходить через энергетический барьер по туннельному механизму.
Стекла, применяемые для изготовления электродов, должны иметь следующие свойства: невысокое сопротивление, малый потенциал асимметрии, небольшую щелочную ошибку. Они не должны также заметно растворяться, иначе рН приэлектродного слоя будет отличаться от рН в глубине раствора. Чаще других для изготовления стеклянных электродов используют легкоплавкое натриевое стекло, состоящее из 72% SiО2, 6% СаО и 22% Na2О, или литиевое стекло (72% SiО2, 6% СаО и 22% Li2О). При введении в состав стекла оксидов алюминия и бора можно изготовить электроды, которые дают отклик не на рН, а на изменение концентрации (активности) катионов натрия, лития, аммония, серебра и других ионов. Например, для изготовления натрий-чувствительных электродов применяют стекло следующего состава: 11% Na2О, 18% А12О3 и 71% SiО2. Такие электроды имеют высокую избирательность по отношению к ионам натрия в присутствии других однозарядных катионов (кроме ионов Н+ и Ag+). Так, коэффициент селективности KNa/K для натрий-чувствительного электрода достигает 10-3–10-5, т.е. электрод позволяет определять концентрацию ионов натрия в присутствии большого избытка ионов калия. Селективность натрий-чувствительного стеклянного электрода по отношению к различным ионам уменьшается в ряду: Ag+ > Н+ > Na+ >> К+, Li+, Rb+, Cs+ >> Са2+ и другие двухзарядные ионы. Для получения надежных результатов при использовании этого электрода необходимо строго контролировать величину рН. При этом концентрация ионов Н+ должна быть в 100 – 10 000 раз меньше концентрации ионов Na+. Мешающее действие ионов Ag+ легко устраняется путем их осаждения.
Применяются стеклянные мембраны, чувствительные к ионам Li+. Коэффициенты селективности KLi/Na и KLi/K таких мембран приблизительно равны 0,3 и 0,001 соответственно.
Попытки изготовить калий-селективный стеклянный электрод до настоящего времени оказались безуспешными. Все сорта стекол, которые применялись для этих целей, оказались обратимыми и к другим однозарядным ионам. Такие электроды называют катион-чувствительными. Чтобы перевести электрод из одной формы в другую, его обычно вымачивают длительное время в растворе, содержащем соответствующий ион металла, время от времени заменяя раствор. У катион-чувствительных стеклянных электродов коэффициенты селективности к различным ионам убывают в ряду: H+ > К+ > Na+ > NH4+ , Li+, Rb+, Cs+ > Ca2+ и т.д. В отсутствие ионов натрия и калия (что бывает крайне редко) катион-чувствительные электроды достаточно хорошо реагируют на ионы NH+, Li+, Tl+, Cu+, Rb+, Cs+, Ag+ и могут служить датчиками при потенциометрическом титровании этих ионов. Как и при применении натрий-чувствительных электродов, мешающее действие ионов Н+ в этом случае устраняют, поддерживая концентрацию последних на низком уровне.
Разработаны также электроды на основе халькогенидных стекол (28% Ge, 60% Se, 12% Sb), легированных Fe (≈2%), которые имеют нернстовский отклик к ионам Fe (III) и Сu (II). Еще один электрод из халькогенидного стекла состава Cu6AS4S9 чувствителен к ионам Сu (II), что позволяет использовать его для определения меди при концентрации до 1 мкг/л. Предложены и другие электроды такого типа, селективные к Cu2+, Pb2+, Ag+.
Стеклянные электроды можно использовать для измерений в неводных и смешанных растворителях. В смешанных растворителях (смеси воды с ацетоном, этанолом, этиленгликолем, формамидом и др.) стеклянные электроды обычно сохраняют свою функцию по отношению к определяемым ионам, хотя при этом и наблюдается изменение коэффициентов селективности. При высоких концентрациях органического растворителя обнаруживаются некоторые сокращения линейных участков кривых E – рН. Так, в 50% и 70%-ном этаноле отклонения наступают при рН 7 и 8 соответственно. В метаноле потенциал стеклянных электродов стабилен. Потенциал стеклянного электрода удовлетворительно следует водородной функции в пероксиде водорода, в муравьиной и уксусной кислотах, в ацетоне, ацетонитриле, хинолине и пиридине, а также в диметилформамиде.
Применимость стеклянных электродов в неводных растворителях ограничивается высоким сопротивлением раствора. Чтобы увеличить электропроводность в растворителях с низкой диэлектрической проницаемостью добавляют фоновый электролит или раствор соли. Для этой цели применимы, например, СН3(С4Н9)3NI в концентрации ~ 10-3 моль/л, а также растворы хлорида лития в смеси бензола с метанолом и ацетата Сu2+ в уксусной кислоте. В качестве фоновых электролитов можно использовать и перхлораты лития и натрия.
Следует заметить, что в неводных средах стеклянные электроды даже одного и того же образца могут проявлять разные свойства в зависимости от условий предварительной обработки. В большинстве случаев электрод перед употреблением оставляют «набухать» на 12-48 час в растворителе, в котором предполагается его использовать. Трудности возрастают, если в процессе работы необходимо заменить один растворитель другим. Шкала рН, отнесенная к водному стандарту, в неводных средах не может быть использована.
Учитывая, что стеклянные электроды имеют очень высокое сопротивление, от 1 до 500 МОм, для измерения электродных потенциалов применяют электронные вольтметры с входным сопротивлением порядка 1011 - 1012 Ом. Погрешность измерений в настоящее время практически не зависит от рН-метра, а определяется самим стеклянным электродом и стандартными растворами, используемыми для калибровки.
При проведении градуировки рН-метра потенциал стеклянного электрода измеряют сначала в растворе, содержащем стандартный буфер. С помощью кнопки регулировки нуля на приборе устанавливают показание, соответствующее рН раствора. Затем электрод извлекают из него, промывают, помещают во второй стандартный буферный раствор с другим рН и кнопкой регулировки усиления рН-метра устанавливают показание, соответствующее рН этого буфера. Далее электрод вновь извлекают из раствора, промывают и помещают в первый буфер. Если необходимо, проводят повторную регулировку нуля рН-метра. Процесс повторяют до тех пор, пока обоим значениям рН буферных растворов не будут соответствовать правильные показания прибора. После этого электрод промывают, помещают в раствор с неизвестным рН и определяют его значение. Многие рН-метры снабжены не двумя, а тремя кнопками регулировки. Третья кнопка необходима для обеспечения температурной компенсации показаний прибора. В последнее время рН-метры снабжают термисторами, которые автоматически компенсируют влияние изменения температуры.