
- •26.)Тепловое излучение и его характеристики
- •27.)Законы теплового излучения
- •Законы теплового излучения
- •28.)Квантовая гипотеза и формула Планка
- •29.)Энергия и импульс световых квантов. Давление света
- •30.)Внешний, внутренний и вентильный фотоэффект
- •31.)Эффект Комптона и его теория
- •32.)Строение атома водорода в соответствии с теорией Бора
- •33.)Свойства рентгеновского излучения
- •34.)Основные постулаты квантовой механики
- •35.)Волновая функция и уравнение Шредингера
- •36.)Примеры решений уравнения Шредингера
- •37.)Атом водорода в квантовой механике
- •40.)Схема уровней энергии и оптические спектры молекул
- •38.)Квантовые числа в атоме
- •41.)Дифракция электронов и нейтронов. Электронная микроскопия
- •39.)Распределение электронов
- •42.)Спонтанное и вынужденное излучение. Люминесценция
- •44.)Общие сведения о квантовых статиках
- •43.)Лазеры
- •45.) Функции распределения Ферми-Дирака и Бозе – Эйнштейна
- •46.)Статические функции квантового газа
- •47.)Вырожденный электронный газ в металлах
- •48.)Квантовая теория теплоёмкости твёрдых тел
- •49.)Элементы квантовой теории металлов
- •50.)Зонная теория строения твёрдых тел
40.)Схема уровней энергии и оптические спектры молекул
Виды химической связи в молекуле: ионная (ионы с противоположными зарядами) и атомная (электроны с противоположно направленными спинами)..
Энергия
молекулы:
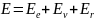
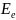 – электронная
энергия;
– электронная
энергия;
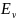 – колебательная
энергия;
– колебательная
энергия;
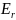 – вращательная
энергия;
– вращательная
энергия;
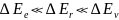
Квантование колебательных и вращательных составляющих энергии молекулы:
Вращательный спектр состоит из равноотстоящих линий, расположенных в очень далёкой инфракрасной области.
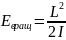 -
энергия вращательного движения, L-момент
количества движения, I-
момент инерции.
-
энергия вращательного движения, L-момент
количества движения, I-
момент инерции.
 , j
квантовое число для системы в целом
, j
квантовое число для системы в целом
Колебательный
спектр
состоит из линий с частотами:
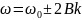 .
.
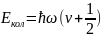 -
энергия
колебательного движения, ħ- постоянная
Планка, w-квантовое
число, ½ свидетельствует о нулевых
колебаний.
-
энергия
колебательного движения, ħ- постоянная
Планка, w-квантовое
число, ½ свидетельствует о нулевых
колебаний.
Спектры молекулы состоят из большого числа тесно расположенных линий.
38.)Квантовые числа в атоме
Квантовые числа – целые или дробные числа, определяющие возможные значения физических величин, характеризующих квантовую систему (молекулу, атом, атомное ядро, элементарную частицу). Квантовые числа отражают дискретность (квантованность) физических величин, характеризующих микросистему. Набор квантовых чисел, исчерпывающе описывающих микросистему, называют полным. Так состояние электрона в атоме водорода определяется четырьмя квантовыми числами: главным квантовым числом n (может принимать значения 1, 2, 3, …), определяющим энергию Еn электрона (Еn = -13.6/n2 эВ); орбитальным квантовым числом l = 0, 1, 2, …, n – 1, определяющим величину L орбитального момента количества движения электрона (L = [l(l + 1)]1/2); магнитным квантовым числом m < ± l , определяющим направление вектора орбитального момента; и квантовым числом ms = ± 1/2, определяющим направление вектора спина электрона.
n- Главное квантовое число: n = 1, 2, … .
J- Квантовое число полного углового момента. j никогда не бывает отрицательным и может быть целым (включая ноль) или полуцелым в зависимости от свойств рассматриваемой системы. Величина полного углового момента J связана с j соотношением
J2 = 2j(j + 1). = + , где и векторы орбитального и спинового угловых моментов.
l-Квантовое число орбитального углового момента l может принимать только целые значения: l = 0, 1, 2, … . Величина орбитального углового L момента связана с l соотношением L2 = 2l(l + 1).
m- Магнитное квантовое число. Проекция полного, орбитального или спинового углового момента на выделенную ось (обычно ось z) равна m.
Для полного момента mj = j, j-1, j-2, …, - (j-1), - j. Для орбитального момента ml = l, l-1, l-2, …, -(l-1), -l.
Для спинового момента электрона, протона, нейтрона, кварка ms = ±1/2
s- Квантовое число спинового углового момента s может быть либо целым, либо полуцелым. s - неизменная характеристика частицы, определяемая ее свойствами. Величина спинового момента S связана с s соотношением S2 = 2s(s + 1).
P- Пространственная четность. Она равна либо +1, либо -1 и характеризует поведение системы при зеркальном отражении. P = (-1)l.
Спин электрона — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе. Если электрону приписывается собственный механический момент импульса (спин) ls, то ему соответствует собственный магнитный момент pms. Согласно общим выводам квантовой механики, спин квантуется по закону Ls=h(s(s+1)), где s — спиновое квантовое число. По аналогии с орбитальным моментом импульса, проекция Lsz спина квантуется так, что вектор Ls может принимать 2s+1 ориентации. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2s+1=2, откуда s=1/2. Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением, аналогичным (223.6): Lsz=hms, где ms — магнитное спиновое квантовое число; оно может иметь только два значения: ms= ±1/2. Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
