
- •26.)Тепловое излучение и его характеристики
- •27.)Законы теплового излучения
- •Законы теплового излучения
- •28.)Квантовая гипотеза и формула Планка
- •29.)Энергия и импульс световых квантов. Давление света
- •30.)Внешний, внутренний и вентильный фотоэффект
- •31.)Эффект Комптона и его теория
- •32.)Строение атома водорода в соответствии с теорией Бора
- •33.)Свойства рентгеновского излучения
- •34.)Основные постулаты квантовой механики
- •35.)Волновая функция и уравнение Шредингера
- •36.)Примеры решений уравнения Шредингера
- •37.)Атом водорода в квантовой механике
- •40.)Схема уровней энергии и оптические спектры молекул
- •38.)Квантовые числа в атоме
- •41.)Дифракция электронов и нейтронов. Электронная микроскопия
- •39.)Распределение электронов
- •42.)Спонтанное и вынужденное излучение. Люминесценция
- •44.)Общие сведения о квантовых статиках
- •43.)Лазеры
- •45.) Функции распределения Ферми-Дирака и Бозе – Эйнштейна
- •46.)Статические функции квантового газа
- •47.)Вырожденный электронный газ в металлах
- •48.)Квантовая теория теплоёмкости твёрдых тел
- •49.)Элементы квантовой теории металлов
- •50.)Зонная теория строения твёрдых тел
41.)Дифракция электронов и нейтронов. Электронная микроскопия
Корпускулярно-волновой дуализм для электронов и нейтронов - важнейшее универсальное свойство природы, заключающееся в том, что всем микрообъектам присущи одновременно и корпускулярные и волновые характеристики. Так, напр., электрон, нейтрон, фотон в одних условиях проявляются как частицы, движущиеся по классич. траекториям и обладающие определ. энергией и импульсом, а в других - обнаруживают свою волновую природу, характерную для явлений интерференции и дифракции частиц.
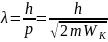
Принцип действия электронного микроскопа: тонкий электронный зонд (электронный пучок) направляется на анализируемый образец. В результате взаимодействия между электронным зондом и образцом возникают низкоэнергетичные вторичные электроны, которые отбираются детектором вторичных электронов. Каждый акт столкновения сопровождается появлением электрического сигнала на выходе детектора. Интенсивность электрического сигнала зависит как от природы образца (в меньшей степени), так и от топографии (в большей степени) образца в области взаимодействия. Таким образом, сканируя электронным пучком поверхность объекта возможно получить карту рельефа проанализированной зоны.
ЭЛЕКТРОНОГРАФИЯ— метод структурного анализа тонкодисперсных м-лов, кристаллы которых проницаемы для электронов. Задачи Э.: диагностика, детальное структурное изучение м-лов, выявление их тонких отличий от др. родственных м-лов, строгое определение полиморфных модиф., характеристика нарушения упорядоченности и определение содер. тех минер. компонентов, которые доступны для дифракции электронов. Достоинством метода является: возможность исследования очень малых количеств вещества (10-5 г), наблюдение дифракционной картины на экране, что позволяет выбрать наиболее интересные участки препарата, фотосъемка электронограмм с ничтожно малыми временем. Дифракция электронов осуществляется в вакуумных приборах — электронографах и электронных микроскопах.
39.)Распределение электронов
Типы частиц: бозоны (симметричны) и фермионы (антисимметричны)
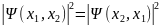 -возможно,
если : 1)
-возможно,
если : 1)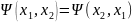 -
симметрична, 2)
-
симметрична, 2)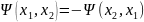 -
антисимметрична.
-
антисимметрична.
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформулировал принцип, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули). Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925) еще до построения квантовой механики: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, l, ml и ms, т. е. Z (n, l, ml, ms)=0 или 1, где Z (n, l, ml, ms) — число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: n, l, ml, ms. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется. Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел: главного n (n=1, 2, 3, ...), орбитального l (l=0, 1, 2, ..., n-1), магнитного ml (ml= -l, ..., -1, 0, + 1, ..., +l), магнитного спинового ms (ms=+1/2, -1/2). Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа. Максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
Z(n)=
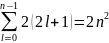
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку орбитальное квантовое число принимает значения от 0 до n-1, число подоболочек равно порядковому номеру n оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2l+1).
