
- •Кафедра общей и технической физики
- •ДИФРАКЦИЯ ЭЛЕКТРОНОВ
- •Методические указания к лабораторным работам
- •САНКТ-ПЕТЕРБУРГ
- •Научный редактор доц. Ю.И. Кузьмин
- •ВВЕДЕНИЕ
- •Кафедра общей и технической физики
- •ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ ЭФФЕКТА ХОЛЛА
- •Методические указания к лабораторной работе
- •САНКТ-ПЕТЕРБУРГ
- •Научный редактор доц. Т.В. Стоянова
- •ВВЕДЕНИЕ
- •СОДЕРЖАНИЕ ОТЧЁТА
- •Кафедра общей и технической физики
- •ЯВЛЕНИЯ ПЕРЕНОСА И ЭЛЕМЕНТЫ КВАНТОВОЙ СТАТИСТИКИ
- •Методические указания к лабораторным работам
- •САНКТ-ПЕТЕРБУРГ
- •Научный редактор доц. Т.В. Стоянова
- •Кафедра общей и технической физики
- •Опыт Франка – Герца
- •Методические указания к лабораторным работам
- •САНКТ-ПЕТЕРБУРГ
- •Научный редактор доц. Т.В. Стоянова
- •ВВЕДЕНИЕ
- •Кафедра общей и технической физики
- •Р-N-ПЕРЕХОД И ЕГО ПРИМЕНЕНИЕ
- •Методические указания к лабораторным работам
- •САНКТ-ПЕТЕРБУРГ
- •ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
- •Работа 8. Исследование температурных характеристик диодов
- •ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ПРОБИВНОЕ НАПРЯЖЕНИЕ ДИОДА
- •ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА
- •ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
- •ОБРАБОТКА РЕЗУЛЬТАТОВ
- •ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ И ПРОВЕРКИ ВЛАДЕНИЯ МАТЕРИАЛОМ
- •ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ ОТЧЁТА
- •СОДЕРЖАНИЕ
- •Кафедра общей и технической физики
- •СОЛНЕЧНЫЕ ЭЛЕМЕНТЫ
- •Методические указания к лабораторным работам
- •САНКТ-ПЕТЕРБУРГ
- •Научный редактор доц. Т.В. Стоянова
- •ВВЕДЕНИЕ
- •Национальный минерально-сырьевой университет «Горный»
- •Кафедра общей и технической физики
- •САНКТ-ПЕТЕРБУРГ
- •Теоретические основы лабораторной работы
- •Описание установки
- •Порядок выполнения
- •Контрольные вопросы
- •Кафедра общей и технической физики
- •ОПРЕДЕЛЕНИЕ ШИРИНЫ ЗАПРЕЩЁННОЙ ЗОНЫ ГЕРМАНИЯ
- •Методические указания к лабораторным работам
- •САНКТ-ПЕТЕРБУРГ
- •Научный редактор доц. Н.А. Тупицкая
- •ВВЕДЕНИЕ
- •1.5 Примесная проводимость
- •общая физика
- •ФИЗИКА ТВЕРДОГО ТЕЛА
- •Основные теоретические сведения
- •Выполнение работы
- •Работа 6. Гальваномагнитные явления в твердых телах
- •Порядок проведения работы
- •Содержание отчета
- •СОДЕРЖАНИЕ
- •Примесные полупроводники
- •Акцепторные полупроводники.
- •Металлы
- •3.3. Контакт металл-полупроводник
- •а полная концентрация дырок в валентной зоне p, соответственно, равна
- •Электропроводность кристалла
- •Примеры решения задач
- •12. Контактные явления
- •Примеры решения задач
- •К-серия
- •8. Спектры молекул
- •Жесткость молекулы
- •Характерную частоту вращательного движения можно оценить как
- •а полная концентрация дырок в валентной зоне p, соответственно, равна
- •Электропроводность кристалла
- •Примеры решения задач
- •12. Контактные явления
- •15. Элементы дозиметрии излучений
- •Константы двухатомных молекул
vk.com/club152685050 | vk.com/id446425943
Физические параметры полупроводников (Т = 300 К)
Полупроводник |
Периодрешетки |
Плотность, Мг/м3 |
Температураплавления, С |
коэффициент.Темп линейногорасширения, 10 |
запрещеннойШирина зоныE |
dE |
Подвижность , |
Низкочастотная диэлектрическая проницаемость |
||
электронов |
|
дырок |
||||||||
|
|
|
|
|
эВ , |
К / эВ |
|
м2/(В с) |
|
|
|
|
|
|
К – 1 |
g |
|
|
|
|
|
|
|
|
|
6 |
|
,dT |
|
|
|
|
|
|
|
|
|
|
/ |
|
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ge |
0,565 |
5,43 |
937 |
5,8 |
0,66 |
0,39 |
0,39 |
|
0,19 |
16,0 |
Si |
0,542 |
2,33 |
1451 |
2,3 |
1,12 |
0,28 |
0,14 |
|
0,05 |
12,5 |
GaAs |
0,565 |
5,32 |
1238 |
5,4 |
1,43 |
0,40 |
0,95 |
|
0,045 |
13,1 |
InSb |
0,648 |
5,78 |
525 |
4,9 |
0,18 |
0,30 |
7,8 |
|
0,075 |
17,7 |
GaSb |
0,610 |
5,65 |
710 |
6,1 |
0,72 |
0,36 |
0,4 |
|
0,14 |
15,7 |
InAs |
0,606 |
5,67 |
942 |
4,7 |
0,36 |
0,35 |
3,3 |
|
0,046 |
14,6 |
GaP |
0,545 |
4,07 |
1467 |
4,7 |
2,26 |
0,47 |
0,019 |
|
0,012 |
11,1 |
ZnS |
0,541 |
4,09 |
1020* |
– |
3,67 |
0,53 |
– |
|
– |
5,2 |
ZnS* |
а = 0,382 |
4,10 |
1780 |
6,2 |
3,74 |
0,38 |
0,014 |
|
0,0005 |
5,2 |
с = 0,626 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
GaN* |
а = 0,319 |
6,11 |
1700 |
5,7 |
3,40 |
0,39 |
0,03 |
|
– |
12,2 |
С = 0,518 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Структура вюрцита ** Температура фазового перехода
Константы двухатомных молекул
|
Межъядерное |
Частота |
|
Межъядерное |
Частота |
Молекула |
расстояние d, |
колебаний ω, |
Молекула |
расстояние d, |
колебаний ω, |
|
10–8 см |
1014 c–1 |
|
10–8 см |
1014 c–1 |
|
|
|
|
|
|
H2 |
0,741 |
8,279 |
НF |
0,917 |
7,796 |
N2 |
1,094 |
4,445 |
HCl |
1,275 |
5,632 |
O2 |
1,207 |
2,977 |
НВr |
1,413 |
4,991 |
F2 |
1,282 |
2,147 |
НI |
1,604 |
4,350 |
S2 |
1,889 |
1,367 |
СО |
1,128 |
4,088 |
Cl2 |
1,988 |
1,064 |
NО |
1,150 |
3,590 |
|
|
|
|
|
|
80

vk.com/club152685050 | vk.com/id446425943
Массы некоторых изотопов и нейтральных атомов
Элемент |
Изотоп |
Масса, а.е.м. |
Водород |
H |
1,00783 |
|
|
|
|
21 H |
2,01410 |
|
H |
3,01605 |
Гелий |
23 He |
3,01605 |
|
He |
4,00260 |
Литий |
Li |
7,01601 |
|
|
|
Бериллий |
74 Be |
7,01169 |
Бор |
105 B |
10,01294 |
|
115 B |
11,00931 |
Азот |
N |
14,00307 |
|
|
|
Кислород |
168 O |
15,99492 |
|
O |
16,99913 |
Неон |
Ne |
19,99244 |
|
|
|
Магний |
Mg |
23,98504 |
|
|
|
|
2712 Mg |
26,98436 |
Элемент |
Изотоп |
Масса, а.е.м. |
Алюминий |
2712 Al |
26,98135 |
Фосфор |
P |
32,97174 |
|
|
|
Сера |
1633S |
32,97146 |
Кремний |
Si |
26,81535 |
|
|
|
Медь |
1964 Cu |
63,5400 |
Кальций |
Ca |
47,95236 |
|
|
|
Железо |
Fe |
55,94700 |
|
|
|
Серебро |
10847 Ag |
107,869 |
Барий |
13756 Ba |
136,9058 |
Вольфрам |
18474W |
183,8500 |
Радий |
Ra |
226,0254 |
|
|
|
Торий |
Th |
232,038 |
|
|
|
Свинец |
Pb |
206,9759 |
|
|
|
Уран |
U |
238,0508 |
|
|
|
81
vk.com/club152685050 | vk.com/id446425943
Периодическая система химических элементов Д.И.Менделеева
|
Период |
|
Ряд |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Группы элементов |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
I |
|
|
II |
|
|
|
|
III |
|
|
IV |
|
V |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
1 |
|
H |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,00797 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Водород |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
2 |
|
Li |
3 |
|
Be |
4 |
|
|
B |
5 |
C |
|
6 |
|
N |
7 |
|
|||
|
|
|
|
|
|
6,939 |
|
9,0122 |
|
|
10,811 |
|
12,011115 |
|
14,0067 |
|
|||||||
|
|
|
|
|
Литий |
|
|
Бериллий |
|
Бор |
|
Углерод |
|
Азот |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
|
3 |
|
Na |
11 |
|
Mg |
12 |
|
|
Al |
13 |
|
Si |
|
14 |
|
P |
15 |
|
||
|
|
|
|
|
|
22,9898 |
|
24,305 |
|
|
26,9815 |
|
|
|
28,086 |
|
30,9738 |
|
|||||
|
|
|
|
|
Натрий |
|
|
Магний |
|
Алюминий |
|
Кремний |
|
Фосфор |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IV |
|
4 |
|
K |
|
19 |
|
Ca |
20 |
|
|
21 |
|
Sc |
|
22 |
|
Ti |
|
23 |
V |
|
|
|
|
|
|
|
39,102 |
|
40,08 |
|
44,956 |
|
|
47,90 |
|
|
50,942 |
|
||||||
|
|
|
|
|
Калий |
|
|
Кальций |
|
|
Скандий |
|
|
|
Титан |
|
Ванадий |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
29 |
Cu |
|
30 |
Zn |
|
Ga |
31 |
|
Ge |
|
15 |
|
As |
33 |
|
|||
|
|
|
|
|
63,546 |
|
|
65,37 |
|
|
|
|
69,72 |
|
|
|
75,59 |
|
74,9216 |
|
|||
|
|
|
|
|
|
Медь |
|
Цинк |
|
Галлий |
|
Германий |
|
Мышьяк |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
6 |
|
Rb |
37 |
|
Sr |
38 |
|
|
39 |
|
Y |
|
40 |
|
Zr |
|
41 |
Nb |
||
|
|
|
|
|
|
85,47 |
|
87,62 |
|
88,905 |
|
|
91,22 |
|
|
92,906 |
|
||||||
|
|
|
|
|
Рубидий |
|
Стронций |
|
|
Иттрий |
|
Цирконий |
|
Ниобий |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
47 |
Ag |
|
48 |
Cd |
|
In |
49 |
|
Sn |
|
50 |
|
Sb |
51 |
|
|||
|
|
|
|
|
107,868 |
|
|
112,40 |
|
|
|
|
114,82 |
|
|
|
118,69 |
|
121,75 |
|
|||
|
|
|
|
|
|
Серебро |
|
Кадмий |
|
Индий |
|
Олово |
|
|
Сурьма |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VI |
|
8 |
|
Cs |
55 |
|
Ba |
56 |
|
|
57 |
|
La* |
|
72 |
|
Hf |
|
73 |
Ta |
||
|
|
|
|
|
|
132,905 |
|
137,34 |
|
138,91 |
|
|
178,49 |
|
|
180,948 |
|
||||||
|
|
|
|
|
Цезий |
|
|
Барий |
|
|
|
|
Лантан |
|
|
Гафний |
|
Тантал |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
79 |
Au |
|
80 |
Hg |
|
Tl |
81 |
|
Pb |
|
82 |
|
Bi |
83 |
|
|||
|
|
|
|
|
196,967 |
|
|
200,59 |
|
|
|
|
204,37 |
|
|
|
207,19 |
|
208,980 |
|
|||
|
|
|
|
|
|
Золото |
|
Ртуть |
|
Таллий |
|
Свинец |
|
|
Висмут |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VII |
|
10 |
|
Fr |
87 |
|
Ra |
88 |
|
|
89 |
Ac** |
|
104 |
|
Rf |
|
105 |
Db |
|||
|
|
|
|
|
|
[223] |
|
|
[226] |
|
[227] |
|
|
[261] |
|
|
|
[262] |
|
|
|||
|
|
|
|
|
Франций |
|
Радий |
|
|
|
|
Актиний |
|
Резерфордий |
|
Дубний |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
58 |
Ce |
59 |
Pr |
60 |
Nd |
61 |
Pm |
62 |
Sm |
63 |
Eu |
64 |
Gd |
|
|||||||
|
|
|
|||||||||||||||||||||
|
|
140,12 |
|
|
140,907 |
|
144,24 |
|
[147] |
|
150,35 |
|
151,96 |
|
157,25 |
|
|
||||||
|
|
|
Церий |
Празеодим |
Неодим |
|
Прометий |
Самарий |
Европий |
Гадолиний |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
** |
90 |
Th |
91 |
Pa |
92 |
U |
93 |
Np |
94 |
Pu |
95 |
Am |
96 |
Cm |
|
|||||||
|
|
|
|||||||||||||||||||||
|
|
232,038 |
|
[231] |
|
|
238,03 |
|
[237] |
|
[244] |
|
|
[243] |
|
[247] |
|
|
|||||
|
|
|
Торий |
Протактин |
Уран |
|
Нептуний |
Плутоний |
Америций |
Кюрий |
|
||||||||||||
|
|
|
|
|
|
|
ий |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
82
vk.com/club152685050 | vk.com/id446425943
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VI |
|
|
VII |
|
|
|
|
|
|
|
VIII |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
He |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Обозначение |
|
|
|
Атомный |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
4,0026 |
|
|
|
элемента |
|
|
|
номер |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
Гелий |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Li |
3 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
O |
8 |
F |
9 |
Ne |
10 |
|
|
|
|
|
Литий |
6,939 |
|
|
|
|
|
|
|
|||||
|
|
|
|
15,9994 |
|
|
18,9984 |
|
|
20,173 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Относительная атомная масса |
|
|
|
|
||||||||||||
|
|
|
Кислород |
Фтор |
|
Неон |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
16 |
Cl |
17 |
Ar |
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
32,064 |
|
|
35,453 |
|
|
39,948 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сера |
Хлор |
|
Аргон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 |
Cr |
25 |
Mn |
26 |
Fe |
|
27 |
|
Co |
28 |
|
|
Ni |
|
|
|
||||||||
|
|
|
51,996 |
54,9380 |
55,847 |
|
|
58,9330 |
|
58,71 |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
Хром |
|
Марганец |
|
Железо |
|
|
|
|
|
Кобальт |
|
|
|
|
Никель |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Se |
34 |
Br |
35 |
Kr |
36 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
78,96 |
|
|
79,904 |
|
|
83,80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Селен |
Бром |
|
Криптон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
42 |
Mo |
43 |
Tc |
44 |
Ru |
|
45 |
|
Rh |
46 |
|
|
Pd |
|
|
|
||||||||
|
|
|
95,94 |
[99] |
|
101,97 |
|
|
102,905 |
|
106,4 |
|
|
|
|
|
|
|
|||||||||
|
|
|
Молибден |
|
Технеций |
|
Рутений |
|
|
|
|
|
Родий |
|
|
Палладий |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Te |
52 |
I |
53 |
Xe |
54 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
127,60 |
|
|
126,9044 |
|
|
131,30 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Теллур |
Йод |
|
Ксенон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
74 |
W |
75 |
Re |
76 |
Os |
|
77 |
|
Ir |
78 |
|
|
Pt |
|
|
|
||||||||
|
|
|
183,85 |
186,2 |
|
190,2 |
|
|
192,2 |
|
|
|
195,09 |
|
|
|
|
|
|
||||||||
|
|
|
Вольфрам |
|
|
Рений |
|
|
Осмий |
|
|
|
|
|
Иридий |
|
|
|
Платина |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Po |
84 |
At |
85 |
Rn |
86 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
[210] |
|
|
[210] |
|
|
[222] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Полоний |
Астат |
|
Радон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
106 |
Sg |
107 |
Bh |
108 |
Hs |
|
109 |
|
Mt |
110 |
|
|
|
|
|
|
|
|||||||
|
|
|
[263] |
[262] |
|
[265] |
|
|
[266] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
Сиборгий |
|
|
Борий |
|
Хассий |
|
|
|
Мейтнерий |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
65 |
Tb |
66 |
Dy |
|
67 |
Ho |
|
68 |
Er |
|
69 |
|
Tm |
|
|
70 |
|
Yb |
71 |
Lu |
|||||||
158,924 |
162,50 |
|
|
144,24 |
|
[147] |
|
|
|
150,35 |
|
|
|
|
151,96 |
|
|
|
157,25 |
||||||||
|
Тербий |
|
|
Диспрозий |
|
Гольмий |
|
Эрбий |
|
|
|
|
Тулий |
|
|
Иттербий |
|
Лютеций |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
97 |
Bk |
98 |
Cf |
|
99 |
Es |
|
100 Fm |
|
101 |
|
Md |
|
|
102 |
|
No |
103 |
Lr |
||||||||
[247] |
|
[252] |
|
|
[254] |
|
[257] |
|
|
|
[257] |
|
|
|
|
|
[255] |
|
|
|
|
[256] |
|||||
|
Берклий |
|
Калифорний |
|
Эйнштейний |
|
Фермий |
|
|
Менделеевий |
|
|
Нобелий |
|
Лоуренсий |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
83

vk.com/club152685050 | vk.com/id446425943
Некоторые математические формулы
sin 2 cos2 1 |
sin 1 |
1 ctg2 |
|||||||||
sin sin cos cos sin |
|
|
|
|
|
|
|
||||
|
cos 1 |
|
1 tg 2 |
||||||||
cos cos cos sin sin |
sin |
|
|
||||||||
cos |
|||||||||||
tg |
tg tg |
|
cos |
2 |
|
|
|||||
|
1 cos 2 |
||||||||||
|
|||||||||||
1 tg tg |
|
|
|
|
|
|
|
|
|||
sin sin 2sin  2 cos
2 cos 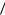 2 exp ia cos isin
2 exp ia cos isin
sin sin cos  sin
sin  sin ei e i
sin ei e i 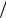 2i
2i
cos cos 2cos 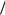 2 cos
2 cos  2
2
cos ei e i  2
2
cos cos sin  sin
sin 
xndx xn 1 n 1 C |
n 1 |
dx x ln x C |
a x dx a x ln a C , если |
а = е, то |
exdx ex C |
sin xdx cos x C |
cos xdx sin x C |
|
|
|
|
|
|
|
|
|
1, |
|
|
n 0 |
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
2, n 1 2 |
|||||||
x |
n |
e |
x |
dx |
|
||||||||
|
|
|
|
|
n 1 |
||||||||
0 |
|
|
|
|
|
|
|
1, |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
n 2 |
||
|
|
|
|
|
|
|
|
2, |
|||||
|
|
|
|
|
|
|
2,31, |
n 1 2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
n 1 |
|
xndx |
2 |
6, |
|||||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
2,405, |
n 2 |
|||||
0 ex 1 |
|||||||||||||
|
|
4 |
|
|
n 3 |
||||||||
|
|
|
|
|
|
|
|
|
15, |
||||
|
|
|
|
|
|
|
|
|
|
|
|
n 4 |
|
|
|
|
|
|
|
|
24,9, |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
n 0 |
|
|
|
|
|
|
|
|
|
2, |
|||
|
|
|
|
|
|
|
|
|
|
|
|
n 1 |
|
|
e |
x 2 |
|
1 2, |
|
||||||
x |
n |
|
|
|||||||||
|
|
|
dx |
|
|
|
n 2 |
|||||
0 |
|
|
|
|
|
|
|
|
|
|
4, |
|
|
|
|
|
|
|
|
|
|
|
|
|
n 3 |
|
|
|
|
|
|
|
|
1 2, |
|
|||
|
|
|
|
|
|
|
0,225, |
1 |
||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
3 |
dx |
1,18, |
|
|
|||||
|
x |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
2,56, |
|
3 |
|||
0 ex 1 |
|
|||||||||||
|
4,91, |
|
|
5 |
||||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6,43, |
|
||||
|
n |
|
ax |
|
1 |
|
n |
|
ax |
|
n |
|
n 1 ax |
|
2 |
|
ax |
|
x2 |
|
2x |
2 |
|
ax |
eax |
||||||
|
|
|
|
|
|
|
|
|
dx x |
|
|
ax |
|
|
|
|
|
|
|
|
|
|
ax 1 |
||||||||
x |
|
e |
|
dx |
|
x |
|
e |
|
|
|
x |
e |
|
e |
|
dx e |
|
|
|
|
|
|
|
|
|
xe dx |
|
|
||
|
|
a |
|
|
a |
|
|
a |
a |
2 |
a |
3 |
a |
2 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
84
vk.com/club152685050 | vk.com/id446425943
|
|
ОГЛАВЛЕНИЕ |
|
1. |
Модель атома Бора |
3 |
|
2. |
Волны де Бройля |
6 |
|
3. |
Соотношение неопределенностей Гейзенберга |
8 |
|
4. |
Введение в квантовую механику. Уравнение Шредингера |
11 |
|
5. |
Потенциальная яма и потенциальный барьер. |
17 |
|
6. |
Строение атома |
22 |
|
7. Рентгеновские спектры атомов. |
28 |
||
8. |
Спектры молекул. |
32 |
|
9. |
Статистика квантовых частиц. Электроны в металле. |
38 |
|
10. |
Фононы и теплоемкость |
44 |
|
11. |
Полупроводники и диэлектрики |
48 |
|
12. |
Контактные явления |
54 |
|
13. |
Строение атомных ядер |
62 |
|
14. |
Радиоактивность |
65 |
|
15. |
Элементы дозиметрии излучений |
68 |
|
16. |
Дефект масс и энергия связи атомных ядер. Ядерные реакции |
71 |
|
17. |
Приложения |
75 |
|
85
vk.com/club152685050 | vk.com/id446425943
Зонная структура твердых тел.
Каждый электрон, входящий в состав атома, обладает определенной полной энергией, т.е. занимает определенный энергетический уровень. Если атомы далеки друг от друга (газ), то взаимодействие между атомами отсутствует, и энергетические уровни остаются неизменными. В твердом теле атомы расположены близко друг к другу. и волновые функции соседних атомов перекрываются. Благодаря этому, т.е. взаимодействию соседних атомов, атомарные энергетические уровни электронов несколько смещаются и расщепляются, образуя энергетические зоны, состоящие из отдельных близко расположенных по энергии уровней (рис.1). Энергетическую зону или совокупность нескольких перекрывающихся энергетических зон, которые образовались в результате расщепления одного или нескольких энергетических уровней отдельных атомов, называют разрешенной зоной. Электроны в твердом теле могут иметь только энергии, соответствующие разрешенной зоне. Между разрешенными зонами находятся запрещенные зоны, т.е. области значений энергий, которыми не могут обладать электроны в идеальном кристалле.
E |
1 |
|
2 |
|
6 |
1 |
3 |
|
EC |
||
|
||
6 |
Eg |
|
1 |
|
EV 4
6
1
5
Рис.1. Энергетические зоны неметаллов. 1 – уровни невозбужденного атома, 2,3,4,5 – разрешенные зоны, 6 – запрещенные зоны, 2,3 – свободные зоны, 4,5 – занятые (заполненные) зоны, 3 – зона проводимости, 4 – валентная зона, Eg – ширина запрещенной зоны, EC – дно зоны проводимости, EV – потолок валентной зоны.
Ширина разрешенных энергетических зон не зависит от размеров кристалла, а определяется природой атомов (глубиной кулоновской потенциальной ямы и ее шириной) и симметрией кристаллической решетки (взаимным расположением потенциальных ям), т.е. перекрытием волновых функций электронов. Так как волновые функции электронов внутренних оболочек атомов сильно локализованы вблизи ядра, то они слабо перекрываются (или почти не перекрываются) и расщепление этих уровней меньше (практически отсутствует), чем расщепление энергетических уровней валентных электронов. Ширина разрешенной зоны валентных электронов не превышает единиц электрон-вольт. Количество уровней в зоне равно числу атомов,
составляющих твердое тело, а энергетическое расстояние между этими уровнями обратно пропорционально количеству атомов. Так как в 1 см3 содержится 1022-1023 атомов, то уровни в зоне отстоят друг от друга по энергии на 10-22-10-23 эВ, т.е.
энергетическая зона практически непрерывна. Достаточно ничтожно малого
vk.com/club152685050 | vk.com/id446425943
энергетического воздействия, чтобы вызвать переход электронов с одного уровня на другой, если там имеются свободные состояния.
Электроны, будучи фермионами (спин равен 1/2), подчиняются принципу Паули. Поэтому на каждом энергетическом уровне может находиться не более двух электронов, причем с противоположно направленными спиновыми магнитными моментами. Соответственно, конечным оказывается и число электронов, заполняющих данную энергетическую зону. Нижние зоны заполнены полностью, а верхние - свободны. Самая верхняя из заполненных зон называется валентной зоной (valence band VB). Ближайшую к ней свободную зону называют зоной проводимости (conduction band CB). Энергетический зазор между ними называется запрещенной зоной EG. Взаимное расположение зоны проводимости и валентной зоны определяет
электрические, оптические и др. свойства твердых тел, а ширина запрещенной зоны является фундаментальной характеристикой вещества: Eg(Si)=1,12 эВ, Eg(Ge)=0,68 эВ,
Eg(GaAs)=1,43 эВ, Eg(Cалмаз)≈5 эВ.
Зонные структуры металлов и неметаллов существенно различается: в металлах валентная зона заполнена не полностью или перекрывается с зоной проводимости (рис.2в). Это позволяет считать, что ширина запрещенной зоны в металлах равна нулю.
Eg>3 эВ |
эВ |
Eg=0 |
Eg<3 |
диэлектрики |
полупроводники |
металлы |
а |
б |
в |
Рис.2. Структура энергетических зон твердых тел.
Внеметаллах запрещенная зона имеет конечную ширину. Формально считается,
что у диэлектриков Eg>3 эВ (рис.2а), а у полупроводников - Eg<3 эВ (рис.2б), однако
это деление условно.
Вполупроводниках и диэлектриках при Т=0 К все электроны находятся в валентной зоне, а зона проводимости абсолютно свободна. Электроны полностью заполненной зоны не могут принять участие в создании электрического тока. Для появления электропроводности необходимо часть электронов перевести из валентной зоны в зону проводимости. Энергии электрического поля недостаточно для такого перехода, требуется другое более сильное воздействие, например, нагревание твердого тела. При нагревании твердого тела средняя кинетическая энергия тепловых колебаний атомов кристаллической решетки приблизительно равна 3/(2kT). При комнатной
температуре эта величина составляет 0,04 эВ, что существенно меньше ширины запрещенной зоны. Однако тепловая энергия неравномерно распределяется между частицами. В каждый момент времени имеется небольшое число атомов, у которых амплитуда и энергия тепловых колебаний значительно превышают среднее значение. При взаимодействии таких атомов с электронами последним может быть передана энергия, достаточная для перехода из валентной зоны в зону проводимости. Чем выше температура и меньше ширина запрещенной зоны, тем больше таких переходов совершается. У диэлектриков ширина запрещенной зоны столь велика, что такие переходы практически не происходят, и они являются изоляторами.
vk.com/club152685050 | vk.com/id446425943
При переходе электрона в зону проводимости появляется свободное состояние в валентной зоне, которое называется «дыркой». Это состояние может быть занято электроном от соседнего атома, что эквивалентно перемещению свободного состояния. Теперь на это состояние может перейти электрон от третьего атома. Таким образом происходят эстафетные переходы электронов с уровня на уровень внутри разрешенной зоны. Это эквивалентно движению дырки в направлении, противоположном движению электронов, т.е. дырка ведет себя как положительно заряженная частица. Получается, что электроны валентной зоны также могут принимать участие в электропроводности, при этом сложное перемещение коллектива электронов валентной зоны можно описать как движение свободной положительно заряженной квазичастицы – дырки, имеющей эффективную массу m*p. Таким образом, в полупроводниках существуют отрицательно заряженные свободные носители заряда – электроны с массой m*n и положительно заряженные дырки с m*p.
Примесные атомы создают дополнительные уровни, расположенные в запрещенной зоне полупроводника (рис.3). При малой концентрации примесей расстояние между примесными атомами велико, волновые функции их валентных электронов не перекрываются друг с другом. Вследствие этого примесные энергетические уровни являются дискретными, т.е. не расщепляются в зону, вероятность перехода электрона от одного примесного атома к другому ничтожно мала. Однако примеси могут поставлять электроны либо в зону проводимости (донорные примеси), либо принимать электроны из валентной зоны (акцепторные примеси).
Вслучае электронного полупроводника (рис.3а) при внешнем воздействии электроны с примесных (донорных) уровней легко переходят в зону проводимости и могут участвовать в процессе электропроводности. Так как энергия, необходимая для
таких переходов ∆ED<<Eg, то при низких температурах (порядка комнатных) доноры
являются основными поставщиками электронов в зону проводимости, вклад собственных носителей ничтожен.
Вслучае дырочного полупроводника (рис.3б) примесные (акцепторные) уровни
находятся вблизи потолка валентной зоны ∆EA<<Eg и при небольшом воздействии
электроны из валентной зоны легко переходят на эти уровни, в валентной зоне появляются дырки.
EC |
EC |
EF
ED
EA
EF
EV |
EV |
а б
Рис.3. Энергетические диаграммы полупроводников электронного (а) и дырочного (б) типов при Т>0 К.
vk.com/club152685050 | vk.com/id446425943
При увеличении концентрации примесей увеличивается вероятность их взаимодействия, (волновые функции электронов примесных атомов начинают перекрываться), происходит расщепление примесных энергетических уровней в зону и уменьшение энергии ионизации примесей. При очень большой концентрации примесей энергия ионизации примесей стремится к 0, т.е. примесная зона сливается с краем разрешенной зоны. В этом случае полупроводник становится вырожденным.
