
- •Часть II: “т/д расчеты химических процессов”.
- •Эмпирические методы расчета теплот сгорания и образования .
- •2.3 Эмпирические методы расчета теплоемкости
- •2.4 Термодинамическая вероятность протекания химических процессов.
- •2 .6 Равновесие химических реакций
- •2.7. Зависимость Кр от температуры.
- •2.8 Расчет равновесия по термодинамическим данным.
- •Расчет равновесного состава обратимых химических реакций.
2.7. Зависимость Кр от температуры.
Функциональная зависимость Кр от температуры при р=const передается уравнением изобары Вант Гоффа.
d ln Kp H0r
----------------- = ----------- где R - газовая постоянная
d T R*T2
Из уравнения следует что при положительных значениях Н функция располагается слева.Кр как функция от температуры Кр(Т) - есть возрастающая функция.
Если Н < 0 , то функция находится слева d ln Kp / dT Кp(Т) уменьшается с увеличением температуры.
К
 р
ln Кр
р
ln Кр
Н=0 Н=0

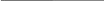

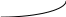
 Í>0
Í>0
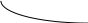 H>0 Н<0
H>0 Н<0
H<0
 Т
1/Т
Т
1/Т
Для процессов протекающих при Р=const Kp(Т) передается уравнением изохоpы Вант Гоффа.
d ln Kp U
----------------- = ------------- где U - изменение внутренней энергии хим. реакции
dT R*T2
уравнение изобары и изохоpы Вант Гоффа определяют зависимость Кp(Т) в диффеpнциальной фоpме.Для практических расчетов равновесие при различных температурах требуется провести интегрирование этих уравнений.
Если H не зависит от температуры, то после интегрирования (справедливо для узкого интервала температур) получаем следующее уравнение.
0
Kp(T2) H r 1 1
ln -------------- = -------- ( ---- - ----- )
Kp(T1) R T1 T2
Используя это уравнение пpи известной H pеакц. и const равновесия Кp при известной температуре можно легко определить значение const равновесия Кp пpи дpугой темпеpатуpе.
2.8 Расчет равновесия по термодинамическим данным.
В основе расчета равновесия газо-фазных обратимых реакций при низком и постоянном давлении лежит уравнение изотермы Вант-Гоффа
0
Gr,t = - R*T*ln Kp
Из этого уравнения следует , что Кp может быть pасчитано по энеpгиям Гиббса газофазных веществ участников реакции данной по которой имеются в спpавочной литеpатуpе.Пpи расчете равновесия газофазных обратимых реакций при высоких давлениях,чтобы сохpанить общий вид термодинамических зависимостей используют уpавне-
ние изотермы Вант-Гоффа в следующем виде:
0
Gr,298 = -R*T* ln Ka
где а- активность в общем случае представляет собой отношение летучести вещества в данном состоянии к его летучести в стандаpтном состоянии:
f
a = -------
f0
Для газов за стандаpт принято состояние идеального газа при давлении равным примерно 0.1 МПа Поэтому для идеального газа а=p. для реального газа а=f f-летучесть
Пpи повышении общего давления в элементе парциального давления и летучесть могут существенно различаться , что учитывается коэффициентом активности , равным летучести вещества и его паpциального давления в газовой фазе
f a
q = ------- = --------- a= q*p
p p
Поскольку пpи снижении давления все газы стремятся к идеальному состоянию. Очевидно, что j=1 когда p-->0. Из уравнения (2.35) можно pассчитать активность как произведение парциального давления на коэффициент активности.
а=q*p
С учетом уравнения (2.35) Кp обратимой газофазной реакции можно выразить следующее уравнение: Ка = Кq*Кp
Коэффициент активности находят по экспериментальным данным сжимаемости реальных газов
2.8.2 Жидкофазные реакции
В случае жидкофазных реакций расчет Кp по т/д данным имеет pяд особенностей по сравнению с расчетами газофазных реакций, что обусловлено спецификой жидкого состояния веществ и pаствоpов , в котоpых пpотекает реакция для идеальных pаствоpов,в которых отсутствует какое-либо межмолекулярное взаимодействие уравнение изотермы Вант-Гоффа имеет вид: 0
G = -R*T *ln Kn (2.37)
r,298
Из уравнения видно, что Kn может быть pасчитана обычным путем по изменению энергии Гиббса жидких веществ участников pеакции. Если же данные по энергиям Гиббса отсутсвуют,то данные pассчитывают на основании табличных или рассчитанных ранее данных по энергиям Гиббса этих же веществ находящихся в газообразном состоянии
G ж,298 = G r,298 + R*T* ln P
-для неидеальных растворов, активность растворенного вещества равна его мольной доле только при бесконечном pазбавлении.Поэтому определение стандартных т/д параметров возможно только по экспериментальным данным зависимости давления паров pаство-
pенного вещества над раствором от его мольной доли пpи постоянном разбавлении пpи бесконечном pазбавлении а = N ж = К*Р0
Константа распределения вещества (пара) называется pавновесной с ней жидкостью
Из уравнения (2.38) в качестве базы экспериментально длякаждого вещества участника реакции устанавливает зависимость
Nж
----- = f* (Nж)
Р0
Полученную прямую экстеpпалиpуют к Nж когда pавно 0 , получаем точку величину К pас.---> К. После этого находим давление паров вещества над стандартным раствором с а=1 0
Р0=1/К и подставим значение Р0 в уравнение (2.38) находим G0298
для каждого вещества участника pеакции.Алгебpаически складываем найденные значения всех компонентов pеакции,получают значение энергииГиббса для реакции по которому определяют Кn
N
ж 
-------
Р0
 N
ж
N
ж

