
3. Кинетика гомогенных химических процессов
В гомогенных процессах все реагирующие компоненты находятся в одной фазы: будь то газ, жидкость или твердое вещество. При каталитической реакции катализатор тоже должен находиться в той же фазе, что и реагирующие вещества.
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
Цель кинетических расчетов установить кинетическую модель реакции.
Для получения кинетической модели первоначально проводят кинетический эксперимент, суть которого заключается в нахождении зависимости концентрации реагирующих веществ (продуктов реакции) от времени при различных условиях.
3.1. Скорость гомогенных химических реакций.
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
1 1 d n i
Vr
=
![]()
(3.1)
(3.1)
i V d
Если реакция протекает без изменения объема, то скорость реакции можно выразить через концентрацию реагентов:
1 d С i
Vr = (3.2)
i d i
Различают истинную и среднюю скорость. Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
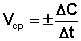 (3.3)
(3.3)
В различных интервалах времени средняя скорость химической реакции имеет разные значения;
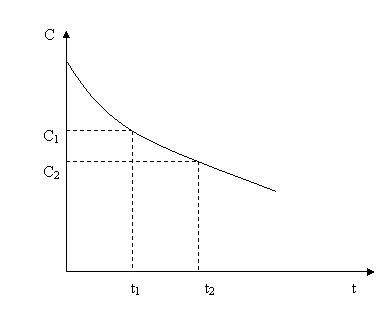 Рис.
3.1
Рис.
3.1
истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
![]() (3.4)
(3.4)
Графическое
изображение зависимости концентрации
реагентов от времени есть кинетическая
кривая
(рис.3.1).
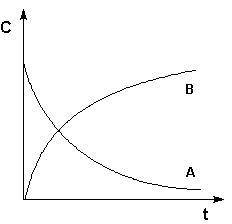
Рис. 3.2 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 3.3); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
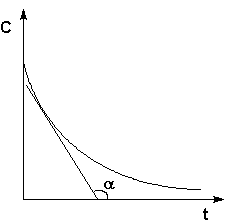
Рис. 3.3 Графическое определение Vист.
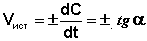 (3.4)
(3.4)
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось.
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Основной закон кинетики.
Зависимость скорости химической реакции от концентрации Сi определяется основным законом кинетики согласно которому Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD + ... ––> еЕ + ...
можно записать:
![]() (3.5)
(3.5)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (3.5) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции.
Для того чтобы найти общий порядок реакции, достаточно в эксперименте исходные вещества (реагенты) взять в стехиометрическом соотношении. Порядок реакции по данному реагенту можно определить, взяв все остальные реагенты в таком избытке, что их изменением можно пренебречь.
При этом общий порядок реакции по данному реагенту можно рассчитать, используя:
а) метод, основанный на зависимости начальной скорости реакции от исходной концентрации реагентов;
б) метод, основанный на зависимости изменяющейся во времени скорости реакции от концентрации реагента.
Рассмотрим эти два метода на примере реакции
А + В → С + D
При использовании первого метода проводят серию опытов с различными исходными концентрациями реагента А (СА,0), снимая зависимость СА(τ).
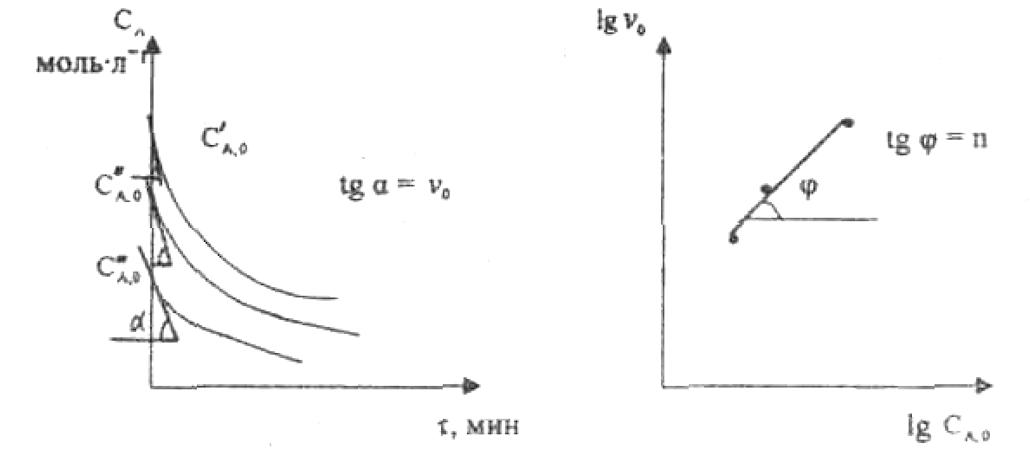
Рис. 3.4 Рис. 3.5
Для каждого опыта определяют известными методами начальную скорость реакции и по уравнению
![]() ,
(3.6)
,
(3.6)
графическим или аналитическим методом определяют порядок реакции.
порядок реакции равен тангенсу угла
наклона прямой к оси
![]()
При применении второго метода в начале определяют в различные моменты времени концентрацию реагента А(СА). Затем строят график зависимости СА(τ), по которому для различных моментов времени находят скорости реакции.
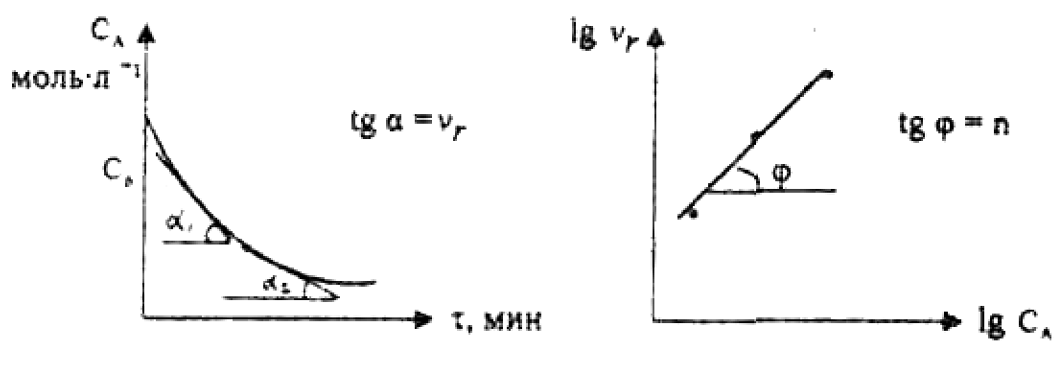
Рис. 3.6 Рис. 3.7
После этого используя известное уравнение
![]() ,
(3.7)
,
(3.7)
графическим или аналитическим методом определяют порядок реакции.
порядок
реакции равен тангенсу угла наклона
прямой к оси
![]() .
.
графическим или аналитическим методом определяют порядок реакции.
