
- •Часть II: “т/д расчеты химических процессов”.
- •Эмпирические методы расчета теплот сгорания и образования .
- •2.3 Эмпирические методы расчета теплоемкости
- •2.4 Термодинамическая вероятность протекания химических процессов.
- •2 .6 Равновесие химических реакций
- •2.7. Зависимость Кр от температуры.
- •2.8 Расчет равновесия по термодинамическим данным.
- •Расчет равновесного состава обратимых химических реакций.
Часть II: “т/д расчеты химических процессов”.
При разработке химических процессов очень важны Т/Д расчеты. Они позволяют сделать заключение о принципе возможности осуществления химического превращения предварительно выбрав условия его проведения, определить равновесный состав реакционной массы для обратимых химических реакций. Рассчитать равновесную стадию превращения, а так же определить энергетические эффекты (теплота реакции, теплота изменения агрегатного состояния и т.д.), что в промышленных условиях необходимо для составления материального и энергетического балансов.
расчет тепловых эффектов химических реакций.

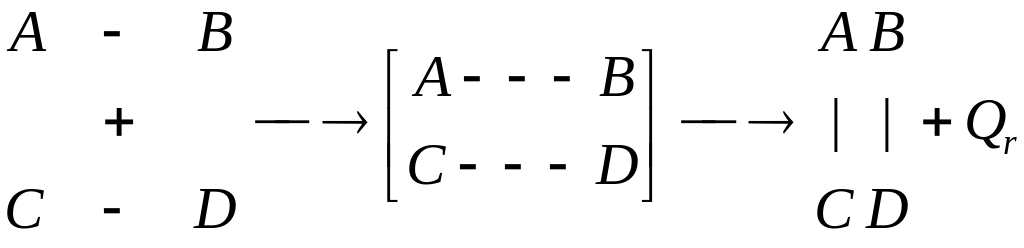
Любая
химическая реакция в общем случае
сводится к разрушению определенного
числа старых химических связей между
атомами в молекуле и образованию новых
связей. При этом
![]() может быть положительной и отрицательной.
Если энергия, которая выделяется при
образовании новых связей больше энергии,
которая затрачивается на разрушение
связей в исходных молекулах, то реакция
протекающая с выделением теплоты
(экзотермическая
реакция).
В этом же случае когда энергия, выделяемая
при образовании новых связей меньше
энергии разрыва старых связей, то реакция
сопровождается поглощением тепла
(эндотермическая
реакция).
Тепло, которое поглощается или выделяется
в химическом процессе - тепловой
эффект химической реакции.
может быть положительной и отрицательной.
Если энергия, которая выделяется при
образовании новых связей больше энергии,
которая затрачивается на разрушение
связей в исходных молекулах, то реакция
протекающая с выделением теплоты
(экзотермическая
реакция).
В этом же случае когда энергия, выделяемая
при образовании новых связей меньше
энергии разрыва старых связей, то реакция
сопровождается поглощением тепла
(эндотермическая
реакция).
Тепло, которое поглощается или выделяется
в химическом процессе - тепловой
эффект химической реакции.
Теплота химической реакции является одной из важных количественных характеристик всего химического процесса, величина и знак которой в значительной мере конструктивное оформление химического оборудования. Расчет тепловых эффектов тепловой реакции протекающей в изобарно-изотермических условиях проводят опираясь на закон Гесса. Из закона Гесса и его следствия следует:
-теплота химической реакции равна сумме теплот образования конечных продуктов реакции за вычетом суммы теплот образования исходных веществ.
![]()

![]() - теплота образования
химического вещества.
- теплота образования
химического вещества.
- теплота химической реакции равна сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания конечных веществ.
![]()

- теплота сгорания химического вещества.
![]() - стехиометрические
коэффициенты уравнения реакции.
- стехиометрические
коэффициенты уравнения реакции.
Закон Гесса позволяет рассчитать тепловой эффект любой химической реакции при наличии справочной литературы, данных по теплотам сгорания или образования веществ участвующих в реакции.
Если такие данные отсутствуют, то прибегают к империческим методам расчета теплот сгорания или образования веществ участвующих в реакции.
Если такие данные отсутствуют, то прибегают к империческим методам расчета теплот сгорания и образования химических веществ.
З акон
Кирхгоффа.
акон
Кирхгоффа.
![]()
где
![]()
Частные случаи:
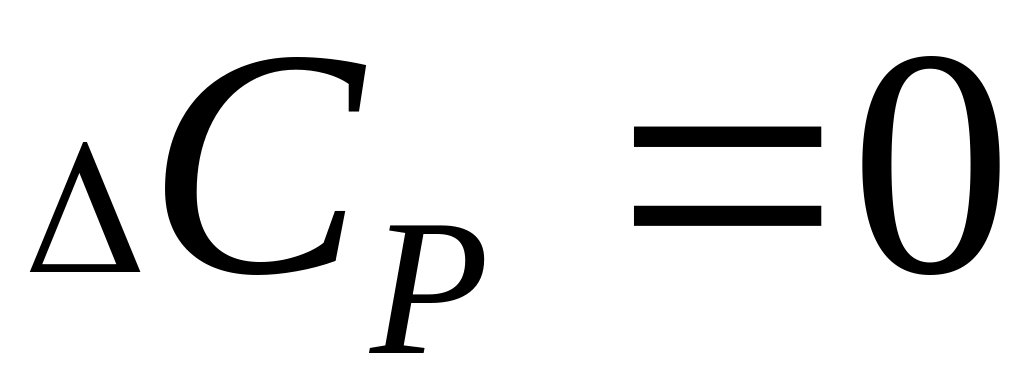 , то
, то
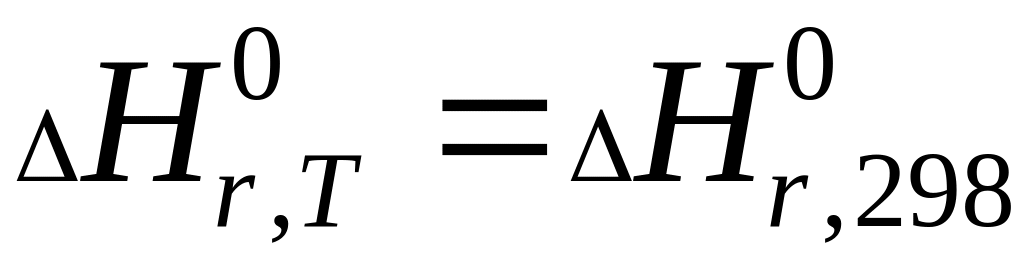
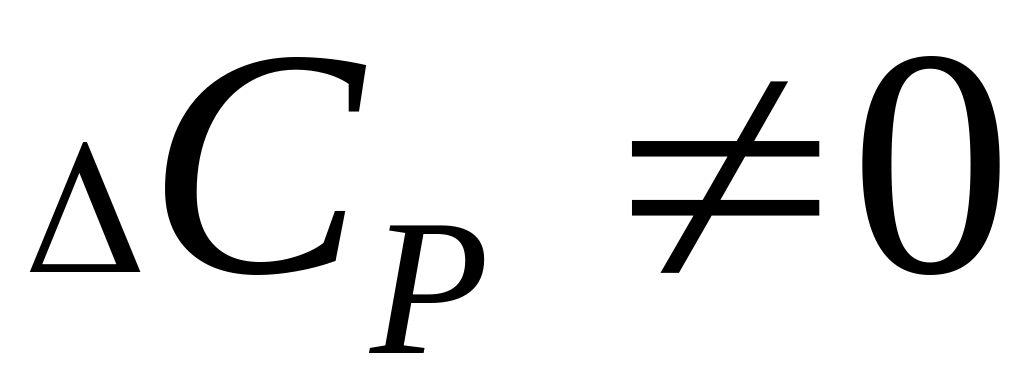 и
и
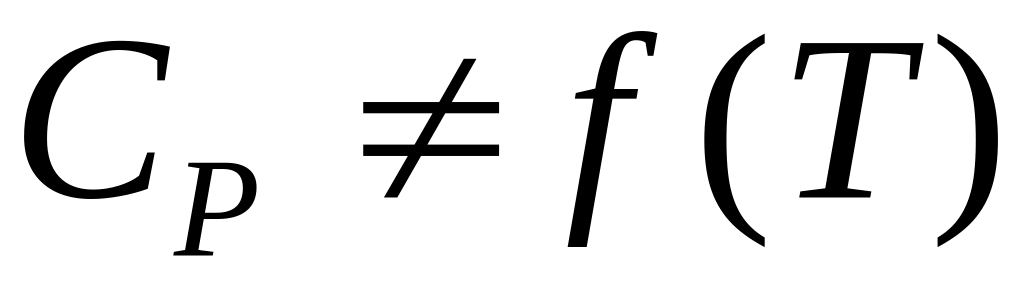 ,
то
,
то
![]()
3 .
и
.
и
![]() и
и
![]() или
или
![]() ,
то
,
то
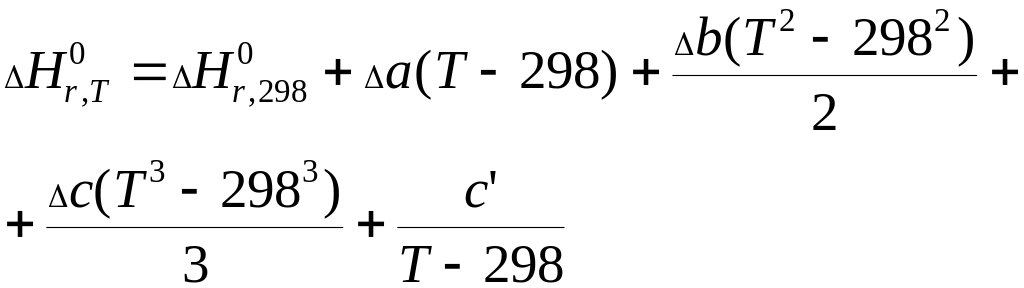
где
![]()
![]() - изменение
коэффициентов.
- изменение
коэффициентов.
Закон Кирхгоффа учитывает зависимость тепловых эффектов от температуры.
Эмпирические методы расчета теплот сгорания и образования .
Расчет газообразных веществ (25 С) по Коновалову.
![]()

- теплота сгорания
органических соединений до
![]() и
и
![]()
48,8 - коэффициент, выражающий теплоту полного сгорания в расчете на 1г атома кислорода.
10,6 - коэффициент, учитывающий теплоту конденсации, образовывается при сгорании вещества водяного пара.
![]() - число атомов
кислорода, необходимое для полного
сгорания вещества.
- число атомов
кислорода, необходимое для полного
сгорания вещества.
![]() - число молей
образуется при сгорании.
- число молей
образуется при сгорании.
![]() - поправочная
величина.
- поправочная
величина.
Для
всех предельных органических соединений
![]() .
.
Для
непредельных:
![]() .
.
Значение постоянно для всех членов гомологического ряда и увеличивается с увеличением непредельности соединений.
![]()
Расчет жидких веществ (при 25 С) по Карашу.

![]()
Караш предложил общий метод вычисления стандартных теплот сгорания при 25 С жидких соединений различных классов.
Рассмотрим
любое органическое соединение, как
углерод, в котором некоторое число
атомов водорода замещено различными
атомами и группами атомов и считая
функции числа
![]() перемешивающихся при горении атомов
окислителя Караш получил данную формулу.
перемешивающихся при горении атомов
окислителя Караш получил данную формулу.
26,05 - теплота разрыва связей С-С, С-Н и последующего образования и .
С - число атомов углерода в соединении.
Н - число атомов водорода в соединении.
Р - число частично смещенных в соединении.
![]() - число одноименных
заместителей.
- число одноименных
заместителей.
![]() -
соответствующая данному заместителю
тепловая поправка.
-
соответствующая данному заместителю
тепловая поправка.
Частично смещать в молекуле соединения могут только атомные силы окислителей, причем количество таких частично смещенных обычно соответствует валентности атомов окислителя в данной молекуле.
Пример:
![]()
![]()
![]()
![]()
![]()
![]()
Метод Караша является приблизительным, позволяющиий получить грубую оценку величины (сгорания). К нему обращаются при отсутствии опытных данных.
Р асчет
по
энергиям связи.
асчет
по
энергиям связи.
![]()
![]() -энергия связи.
-энергия связи.
![]() - число твердых
атомов исходных элементов.
- число твердых
атомов исходных элементов.
![]() - теплота возгонки
для данного элемента.
- теплота возгонки
для данного элемента.
![]() - стехиометрические
коэффициенты уравнения реакции.
- стехиометрические
коэффициенты уравнения реакции.
