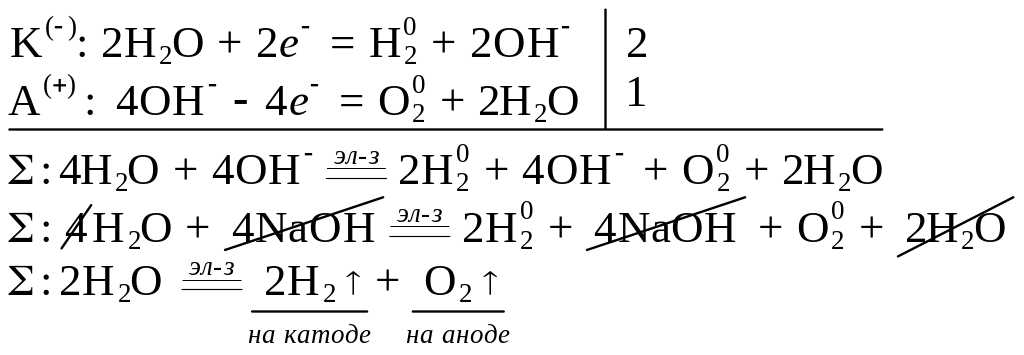- •Химические свойства некоторых кислородсодержащих соединений галогенов
- •Халькогены
- •История открытия
- •Распространение в земной коре
- •Основные характеристики халькогенов
- •I. Взаимодействие с простыми веществами
- •2) Взаимодействует с металлами
- •Получение кислорода
- •1) Электролизом водных растворов щелочей
- •2) При термическом или каталитическом разложении кислородсодержащих соединений
- •1) Перегонкой жидкого воздуха
- •2) Особо чистый кислород получают электролизом растворов щелочей или электролизом воды
- •Роль кислорода в природе
- •Строение молекулы о3
- •Физические свойства озона
- •Химические свойства озона
- •2) Взаимодействует с металлами
- •5) Качественная реакция на озон – йодокрахмальная реакция
- •Получение озона
- •Применение озона
- •Пероксид водорода h2o2 История открытия пероксида водорода
- •Строение молекулы h2o2
- •Физические свойства пероксида водорода
- •Химические свойства пероксида водорода
- •Получение пероксида водорода
- •Применение пероксида водорода
Основные характеристики халькогенов
В ряду O → S → Se → Te → Po :
увеличивается радиус атома (т.к. растет число энергетических уровней), поэтому падают Энергия ионизации и Сродство к электрону (электроны меньше притягиваются к ядру, их проще оторвать);
Металлические свойства возрастают, неметаллические убывают (электроны проще оторвать). O, S, Se – типичные неметаллы, Te – амфотерный элемент, Po – радиоактивный металл;
Окислительная способность падает, а восстановительная (у ионов Э2-) – возрастает (растет радиус атома и падает электроотрицательность, поэтому электроны сложнее принимать и проще отдавать)
КИСЛОРОД О2
СТРОЕНИЕ МОЛЕКУЛЫ О2
Структуру молекулы
кислорода можно представить следующим
образом:
![]()
На внешнем уровне атомов кислорода находится 6 электронов, из которых 2 неспарены. Они образуют двойную связь.
ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
Кислород – бесцветный газ без вкуса и запаха. Жидкий кислород – синяя жидкость.
tкип = -183 °С, tпл = -219 °С. Плохо растворим в воде (5 V/100 V H2O при 0 °С)
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
Кислород – очень сильный окислитель, уступает по своей химической активности только фтору.
Он образует соединения со всеми, кроме He, Ne и Ar.
Характерная особенность многих реакций с кислородом – выделение тепла и света – горение.
I. Взаимодействие с простыми веществами
Непосредственно взаимодействует со всеми простыми веществами при обычной или повышенной температуре (кроме галогенов, инертных газов, Au и Pt). На поверхности некоторых металлов образуется твердая нерастворимая оксидная пленка, препятствующая дальнейшему окислению.
1) Взаимодействует с неметаллами с образованием кислотных оксидов
С + O2 Combin CO2
С + O2 Combin 2CO (в недостатке кислорода)
S + O2 Combin SO2 горит синим пламенем
P + O2 Combin P2O5 горит ярким белым пламенем с образованием белого дыма
N2 + O2 Combin NO – одна из немногих эндотермических реакций с участием кислорода , протекает при t>2000 °C
H2 + O2 Combin H2O температура достигает 3000 °С
2) Взаимодействует с металлами
Mg + O2 Combin MgO
Al + O2 Combin Al2O3 оксидная пленка
3) Взаимодействует со щелочными металлами (кроме Li) с образованием пероксидов и надпероксидов
Na
+ O2
→
![]() пероксид
натрия
пероксид
натрия
Na + O2 →NaO2;\s\up 6( -½ надпероксид натрия
Na2O2 + O2 \s\up 5(P NaO2
K + O2 → KO3;\s\up 7( -1/3 озонид калия
II. Взаимодействие со сложными веществами – окисляет очень многие вещества. Часто в зависимости от избытка-недостатка кислорода или присутствия катализаторов могут быть получены различные продукты:
H2S + O2 (недост.) → S + H2O
H2S + O2 (изб.) → SO2+ H2O
NH3+ O2 Combin NO + H2O
NH3 + O2 → N2 + H2O
NO + O2 → NO2
CuS + O2 → CuO + SO2
CH4 + O2 → CO2 + H2O органические соединения сгорают в кислороде до CO2 и H2O
Окисляет некоторые соли в растворе:
Na2SO3 + O2 → Na2SO4
Вместо кислорода в большинстве реакций можно использовать воздух, однако интенсивность реакции будет меньше
Получение кислорода
В лаборатории
1) Электролизом водных растворов щелочей
NaOH
Combin
![]()