
Лекция № 13
Элементы подгруппы углерода
Элементы главной подгруппы IV группы – N, P, As, Sb, Bi
История открытия
Углерод (С) – "carboneum – уголь (лат.), угарать, обжигать (др. рус.)"
Известен с древних времен.
1791 – Теннант (англ.) получил свободный углерод
1799 – Гитон де Морво (фр.) превратил алмаз в графит
1955 – алмаз получен из графита (t = 3000 °C, P = 10000 атм)
Кремний (Si) – "кремень (др.рус.) – камень; silex – кремень (лат.)"
Известен с древних времен (горный хрусталь, драгоценные камни)
1823 – Й.Я. Берцелиус (швед.) получил аморфный кремний
1855 – Сент Клер-Девиль (фр.) получил кристаллический кремний
Германий(Ge) – от названия Германии – родины первооткрывателя
1871 – его существования предсказал Д. И. Менделеев (назвал его эка-силицием)
1886 – Винклер (нем.) получил германий
Олово (Sn) – от "оловина" – напитка древних славян, который хранился в свинцовых сосудах. Олово часто путали со свинцом. "Stannum – прочно (санскрит)"
Это один из 7 металлов древности (Au, Ag, Hg, Fe, Sn, Pb, Cu), известно с III тыс. лет до н.э. в виде бронзы.
Свинец (Pb) – от слов "с вином" (в свинцовых сосудах хранилось вино). Plumbum – возможно, от "Plumbing – водопроводное дело (с древних времен водопроводные трубы были сделаны из свинца)". Происхождение названия не ясно.
Один из 7 металлов древности известен с III - II тысячелетия до н.э. в Месопотамии, Египте и других древних странах, где из него изготовляли большие кирпичи (чушки), статуи богов и царей, печати и различные предметы быта.
Распространение в земной коре
С – 0,14 %. Однако весьма распространен. В самородном виде (алмаз, графит, уголь). CaCO3 – известняк, мрамор, мел; MgCO3 – магнезит, MgCO3·CaCO3 – доломит. СО2 – 0,03 % в воздухе. Нефть, природный газ – смесь углеводородов. Все живые организмы состоят из соединений углерода (на данный момент существует около 27 млн органических веществ).
Si – 27 %. II место по распространенности. В свободном состоянии не встречается. SiO2 – кремнезем, песок – основа литосферы Земли. Алюмосиликаты – Al2O3·nSiO2·MeO (Me = Ca, Mg, K); полевые шпаты, слюды, глина (каолин) – Al2O3·2SiO2·2H2O; асбест – 3MgO·2SiO2·2H2O.
Ge – 7·10-4 %. В виде сульфидов, сопутствующих медным, железным и серебряным рудам..
Sn –0,04 %. SnO2 – оловянный камень (кассетерит).
Pb – 0,0016 %. В виде минералов – свинцовый блеск (галенит) PbS, англезит PbCO3, церуссит PbSO4.
Углерод с физические свойства углерода
Углерод существует в виде нескольких аллотропных модификаций:
1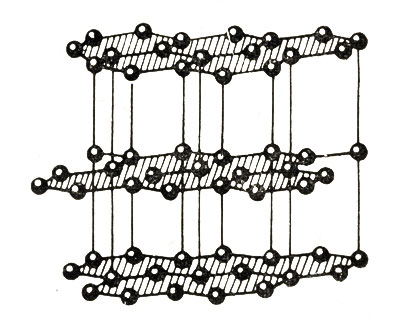 . Графит
– наиболее
распространенная форма.
. Графит
– наиболее
распространенная форма.
Это очень мягкое черное вещество с металлическим блеском, хорошо проводит электрический ток и тепло. Жирный на ощупь, при трении расслаивается на отдельные чешуйки.
tпл = 3750 °С (плавится при давлении 10 МПа, при обычном давлении возгоняется).
Плотность 2,22 г/см3.
Структура графита образована параллельными слоями сеток, состоящих из шестиугольников с атомами углерода в вершинах. Атомы в каждом отдельно взятом слое связаны достаточно прочно, а между слоями связь слабая.
2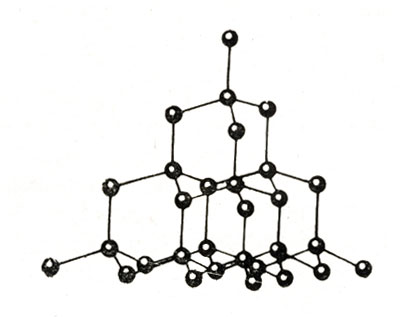 . Алмаз
– бесцветное
(иногда желтоватое, коричневатое,
зеленое, черное, синее, красноватое)
прозрачное вещество, очень сильно
преломляющее лучи света.
. Алмаз
– бесцветное
(иногда желтоватое, коричневатое,
зеленое, черное, синее, красноватое)
прозрачное вещество, очень сильно
преломляющее лучи света.
По твердости превосходит все известные природные вещества. Но обладает хрупкостью. Химически инертен, плохо проводит тепло и электрический ток.
Плотность 3,5 г/см3.
Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Именно прочная связь атомов углерода объясняет высокую твердость алмаза.
При прокаливании алмаза в кислороде при t = 700 °C он превращается в СО2, без кислорода – в графит.
Алмаз можно получить из графита при t = 3000 °C и Р = 6ГПа, Kat – Ni, FeS. Так получают темные технические алмазы – кристаллы диаметром около 4 мм.
Один из них состоит в подготовке высокоуглеродистого сплава Ni-Mn и его охлаждении под давлением в формах из твердого сплава (например, вольфрамо-кобальтового). Выкристаллизовавшиеся мелкие алмазы отделяют после растворения металлической матрицы в смеси кислот.
Отшлифованные прозрачные без дефектов алмазы – бриллианты.
Самый крупный алмаз ("Куллинан") был найден в 1905 г. в ЮАР. Он весил 3106 карат (621 г) и имел размеры 100х65х50 мм. Из него было изготовлено 105 бриллиантов. Его стоимость была оценена в 7,5 млн долларов.
3. Аморфный углерод состоит из мельчайших кристалликов с разноупорядоченной структурой графита.
– Уголь
– Древесный уголь (образуется при нагреве дерева без доступа воздуха)
– Сажа (наиболее чистый аморфный углерод – получается сжиганием богатых углеродом веществ)
– Костяной уголь (получается при обугливании обезжиренных костей животных)
Угли, особенно активированные (обработанные водяным паром) являются адсорбентами – поглощают газы и жидкости своей поверхностью (за счет пористой структуры). 1 грамм активированного угля имеет поверхность 500‑1500 м2 и способен поглотить 88 литров газообразного хлора.
4. Карбин – синтетическая модификация углерода (получена в 1963 г, позднее обнаружена в природе). Черный мелкокристаллический порошок. Плотность 1,9–2 г/см3. Полупроводник.
Карбин является линейным полимером углерода и имеет две разновидности:
![]() и =С=С=С=С=
и =С=С=С=С=
5 . Фуллерен
– синтетическая
структура сферической формы. В молекулах
фуллеренов атомы углерода расположены
в вершинах правильных шести- и
пятиугольников, из которых составлена
поверхность сферы или эллипсоида.
Молекула С60
имеет форму футбольного мяча. Молекула
С70
имеет более вытянутую форму и напоминает
мяч для игры в регби.
. Фуллерен
– синтетическая
структура сферической формы. В молекулах
фуллеренов атомы углерода расположены
в вершинах правильных шести- и
пятиугольников, из которых составлена
поверхность сферы или эллипсоида.
Молекула С60
имеет форму футбольного мяча. Молекула
С70
имеет более вытянутую форму и напоминает
мяч для игры в регби.
Фуллерены получают преимущественно электродуговым, а также электроннолучевым или лазерным распылением графита в атмосфере гелия. Образующаяся сажа конденсируется на холодной поверхности реактора, собирается и обрабатывается в кипящем толуоле, бензоле, ксилоле или других органических растворителях. После выпаривания раствора образуется черный конденсат, который примерно на 10‑15 % состоит из смеси фуллеренов C60 и C70, а также небольших количеств высших фуллеренов.
