
- •Черепкова и. А.. Химико-технологические системы
- •Содержание
- •Введение
- •Тема 1. Химико-технологические процессы и химико-технологические системы
- •1. 1. Классификация химических веществ.
- •Номенклатура химических соединений
- •1. 1. Основные классы неорганических соединений
- •1. 1. 2. Основы номенклатуры неорганических веществ
- •1. 1. 2. 1. Общие положения
- •1. 1. 2. 2. Номенклатура простых веществ
- •1. 1. 2. 3. Номенклатура сложных веществ
- •1. 1. 2. 3. 1. Бинарные соединения
- •1. 1. 2. 3. 2. Многоэлементные соединения
- •1. 1. 2. 4. Тривиальные названия веществ и смесей
- •Тривиальные названия индивидуальных веществ
- •Тривиальные названия смесей и растворов
- •Тема 2. Химическая термодинамика
- •2. 1. Расчет тепловых эффектов химических реакций с использованием стандартных термодинамических функций.
- •2. 2. Расчет изменения энтропии и энергии Гиббса в химических процессах
- •3. Термодинамический анализ возможности протекания химического процесса
- •Тема 3. Химическое равновесие
- •3. 1. Расчет термодинамических и практических констант равновесия
- •2. Расчет глубины и степени превращения исходных веществ, выхода продукта и равновесного состава.
- •3. 3. Влияние концентрации реагентов, внешнего давления и температуры на химическое равновесие.
- •Тема 4. Фазовые равновесия
- •4. 1. Построение и анализ диаграмм температура – состав
- •4. 1. 1. Метод физико-химического анализа. Диаграммы состав – свойство
- •4. 1. 2. Диаграммы температура – состав для идеальных и растворов
- •4. 1. 3. Диаграммы температура – состав для неидеальных растворов
- •4. 1. 4. Правило рычага
- •4. 1.5. Разделение бинарных растворов
- •5. Многовариантные расчетные задания
- •Библиографический список
4. 1. 4. Правило рычага
Диаграммы температура кипения – состав дают возможность оценить не только составы соответствующих фаз, но и их относительные количества. Для этой цели используют так называемое правило рычага, которое можно записать в форме уравнения (см. рис. 4):
![]() ,
,
Если состав раствора выражен не молярными долями, а массовыми (или массовыми процентами), то и количества фаз следует выражать в единицах массы:
![]()
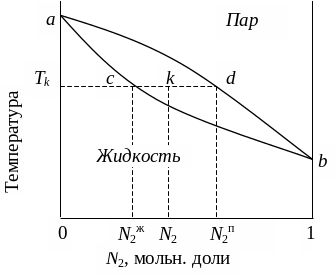
Рис. 4 . К выводу правила рычага
Чтобы найти абсолютные количества надо использовать еще одно соображение: при кипении общее количество веществ в системе остается постоянным, происходит лишь перераспределение веществ между фазами. Таким образом, чтобы определить массу жидкой и паровой фазы при любой температуре надо решить система уравнений:
![]()
![]()
Использование правила рычага не ограничивается упомянутым соотношением количеств жидкости и пара. Оно применимо к любым двухфазным равновесным системам.
Пример 14: Какое количество каждого из компонентов смеси будет находиться в жидкой фазе и в паре, если 0,9 кг раствора (C2H5)2O – CCl4, содержащего 70 % (мол.) (C2H5)2O, нагреть до температуры
60 ºC?
Решение: Количество жидкой и парообразной фазы находится по правилу рычага (рис. 5):
![]()
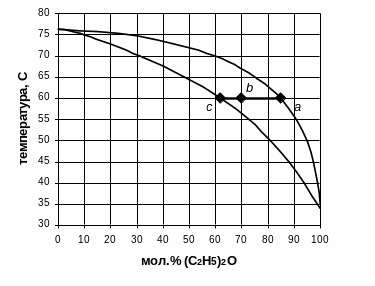
Рис. 5. Правило рычага для диаграммы температура кипения – состав системы (C2H5)2O – CCl4 при стандартном давлении.
Из рис.5 находим координаты точек a, b, c в % (мол.) при T= 60ºC:
![]() :
N(C2H5)2O
= 85 % (мол.) – состав паровой фазы
:
N(C2H5)2O
= 85 % (мол.) – состав паровой фазы
![]() :
N(C2H5)2O
= 70 % (мол.) – состав исходной жидкости
:
N(C2H5)2O
= 70 % (мол.) – состав исходной жидкости
![]() :
N(C2H5)2O
= 62 % (мол.) – состав жидкости
:
N(C2H5)2O
= 62 % (мол.) – состав жидкости
Переведем координаты точек a, b, c из % (мол.) в %(масс.):
% (масс.)=![]()
Здесь M((C2H5)2O) = 74 г/моль – молярная масса (C2H5)2O;
М(CCl4) = 154 г/моль – молярная масса (CCl4).
:
![]()
![]() ;
;
:![]()
![]() ;
;
![]()
![]()
![]()
Составляем систему уравнений
![]()
mж + mп = 0,9 кг
и решаем ее методом подстановки:
mп = 0,9 – mж
![]()
18,261 – 20,29mж = 8,91 mп
![]()
mп = 0,9 – 0,625 = 0,275 кг
Найдем количество каждого компонента в жидкой фазе:
m((C2H5)2O)ж
=
![]()
m(CCl4)ж = mж – m((C2H5)2O)ж = 0,625–0,275 = 0,350 кг
В паре:
m((C2H5)2O)п
=
![]()
m(CCl4)п = mп – m((C2H5)2O)п = 0,275 – 0,201 = 0,074 кг
Проверим полученные результаты:
m = m((C2H5)2O)ж + m(CCl4)ж + m((C2H5)2O)п +m(CCl4)п =
= 0,275 + 0,350 + 0,201 + 0,074 = 0,9 кг
4. 1.5. Разделение бинарных растворов
Для разделения растворов используют разницу в составах равновесных жидкой и парообразной фаз.
1. Перегонка в равновесии (интегральная перегонка, однократное испарение). В этом виде перегонки пар находится в равновесии с испаряющейся жидкостью. Разделения компонентов раствора такой метод не дает. Он позволяет обогатить конденсат одним из компонентов, если не доводить испарение до конца, а остановить его при какой-то температуре. методом интегральной перегонки можно получить две фракции: дистиллят, обогащенный одним компонентом, и жидкость, обогащенную другим компонентом (см. рис. 4 и 5.)
2. Дифференциальная перегонка (постепенное испарение, «простая» перегонка) отличается от интегральной перегонки тем, что образующийся в перегонном кубе пар непрерывно удаляют и конденсируют. Благодаря этому состав системы в перегонном кубе непрерывно изменяется. В условиях отвода пара из перегонного куба испарение жидкости не закончится при температуре конца кипения в интегральной перегонке. Жидкая фаза в пределе станет чистым компонентом, а температура кипения достигнет температуры кипения чистого компонента. Однако количество оставшегося чистого вещества в перегонном кубе крайне мало.
Простую перегонку можно использовать для разделения исходного бинарного раствора на составляющие его компоненты, если раствор не имеет экстремумов на зависимости температуры кипения от состава раствора. При дифференциальной перегонке систем с минимумом температуры кипения (рис. 2а) в кубовом остатке останется тот жидкий компонент, которым обогащен исходный раствор по сравнению с точкой азеотропа c. При дифференциальной перегонке систем с максимумом температуры кипения (рис. 2б) в кубовом остатке останется азеотропный раствор независимо от состава исходного раствора.
3. Ректификация – это наиболее совершенный способ разделения растворов на основе испарения и конденсации. В этом методе используют принцип противотока неравновесных жидкости и пара, обеспечивая их тесный контакт. В ректификационной колонне на некотором уровне пар, поднимаясь вверх, встречает более холодную жидкость (флегму) и, частично конденсируясь, обогащается одним из компонентов. В итоге выходящий из верхней наиболее холодной части ректификационной колонны охлажденный пар почти целиком состоит из одного из компонентов. Его конденсируют, частично используют для орошения колонны (флегма), а большая часть дистиллята является одним из продуктов разгонки – практически чистым компонентом.
Жидкость, стекая вниз и соприкасаясь с более горячим паром, нагревается, частично испаряется и обогащается другим компонентом. В нижней наиболее нагретой части колонны собирается практически чистый другой компонент.
При ректификации растворов с азеотропами (см. рис. 2), в отличие от систем без экстремумов на диаграммах Т – N, в чистом виде может быть получен только один из компонентов. Другим продуктом разгонки обязательно оказывается азеотропный раствор, который ведет себя при испарении как чистая жидкость. В системах с минимумом температуры кипения азеотроп переходит в дистиллят. В нижней части колонны собирается тот практически чистый первый компонент, которым обогащена исходная жидкость по сравнению с азеотропной точкой. В системах с максимумом температуры кипения азеотропный раствор собирается в нижней части колонны, а в дистиллят переходит тот практически чистый первый компонент, которым обогащена исходная жидкость по сравнению с азеотропной точкой.
Пример 15: С помощью диаграммы температура кипения – состав определим, какие продукты можно получить, если подвергнуть раствор (C2H5)2O – CCl4, содержащий 70 % (мол.) (C2H5)2O
а) перегонке в равновесии (интегральной перегонке);
б) простой (дифференциальной) перегонке;
в) ректификации?
Ответ:
а) При перегонке в равновесии пар не отводится, а находится в равновесии с жидкостью. Из диаграммы температура кипения – состав раствора (C2H5)2O – CCl4 (рис.3) следует, что при этом состав пара меняется по линии от 89 до 70 мол.% (C2H5)2O, а жидкости – по линии от 70 до 42 мол.% (C2H5)2O .
Чистые вещества в результате такой перегонки получить нельзя, а можно получить 2 фракции: жидкую (в перегонном кубе), обогащенную четыреххлористым углеродом, и дистиллят (конденсированный пар), обогащенный диэтиловым эфиром.
б) При дифференциальной перегонке пар непрерывно отводится. В результате можно получить чистый четыреххлористый углерод, и он остается в перегонном кубе.
в) В ректификационной колонне пар, поднимаясь вверх и охлаждаясь, обогащается (C2H5)2O. Вверху колонны и, соответственно в дистилляте можно получить чистый диэтиловый эфир. Жидкость, стекая вниз и нагреваясь, обогащается ССl4. Внизу колонны будет собираться практически чистый жидкий четыреххлористый углерод
