
- •Черепкова и. А.. Химико-технологические системы
- •Содержание
- •Введение
- •Тема 1. Химико-технологические процессы и химико-технологические системы
- •1. 1. Классификация химических веществ.
- •Номенклатура химических соединений
- •1. 1. Основные классы неорганических соединений
- •1. 1. 2. Основы номенклатуры неорганических веществ
- •1. 1. 2. 1. Общие положения
- •1. 1. 2. 2. Номенклатура простых веществ
- •1. 1. 2. 3. Номенклатура сложных веществ
- •1. 1. 2. 3. 1. Бинарные соединения
- •1. 1. 2. 3. 2. Многоэлементные соединения
- •1. 1. 2. 4. Тривиальные названия веществ и смесей
- •Тривиальные названия индивидуальных веществ
- •Тривиальные названия смесей и растворов
- •Тема 2. Химическая термодинамика
- •2. 1. Расчет тепловых эффектов химических реакций с использованием стандартных термодинамических функций.
- •2. 2. Расчет изменения энтропии и энергии Гиббса в химических процессах
- •3. Термодинамический анализ возможности протекания химического процесса
- •Тема 3. Химическое равновесие
- •3. 1. Расчет термодинамических и практических констант равновесия
- •2. Расчет глубины и степени превращения исходных веществ, выхода продукта и равновесного состава.
- •3. 3. Влияние концентрации реагентов, внешнего давления и температуры на химическое равновесие.
- •Тема 4. Фазовые равновесия
- •4. 1. Построение и анализ диаграмм температура – состав
- •4. 1. 1. Метод физико-химического анализа. Диаграммы состав – свойство
- •4. 1. 2. Диаграммы температура – состав для идеальных и растворов
- •4. 1. 3. Диаграммы температура – состав для неидеальных растворов
- •4. 1. 4. Правило рычага
- •4. 1.5. Разделение бинарных растворов
- •5. Многовариантные расчетные задания
- •Библиографический список
Тема 4. Фазовые равновесия
4. 1. Построение и анализ диаграмм температура – состав
идеальных и неидеальных растворов
4. 1. 1. Метод физико-химического анализа. Диаграммы состав – свойство
Метод физико-химического анализа применяется для изучения сложных многокомпонентных систем в тех случаях, когда трудно установить точные аналитические зависимости между различными параметрами состояния и свойствами системы.
Физико-химический анализ – это метод, который посредством геометрического исследования диаграмм фактор равновесия - свойство устанавливает число, химическую природу и границы существования фаз в равновесных системах образованных одним, двумя или несколькими компонентами. Основным приемом физико-химического анализа является построение диаграмм состояния в виде диаграмм состав – свойство. Состав на диаграммах обычно откладывают по оси абсцисс, а свойство по оси ординат.
Геометрический метод изучения превращений, происходящих в равновесных системах, основывается на двух основных положениях, сформулированных Курнаковым: принцип непрерывности и принцип соответствия.
Принцип непрерывности заключается в том, что при непрерывном изменении параметров, определяющих состояние системы (давление, температура, концентрация), свойство ее отдельных фаз изменяются тоже непрерывно. При появлении новых или исчезновении существующих фаз свойства системы как целого изменяются скачком.
Принцип соответствия состоит в том, что каждой фазе или комплексу фаз на диаграмме отвечает определенный геометрический образ (точка, линия, поверхность и т.п.).
4. 1. 2. Диаграммы температура – состав для идеальных и растворов
Растворами называются гомогенные системы переменного состава, состоящие из двух или более компонентов.
Идеальные растворы образуются из веществ с примерно одинаковыми размерами молекул и энергиями междучастичных взаимодействий. Обычно это растворы гомологов, например, бензол – толуол, метанол – этанол, о-ксилол – п-ксилол, гексан – гептан.
Идеальные растворы подчиняются закону Рауля:
![]() ,
,
где pi – давление насыщенного пара компонента i над раствором;
p0,i
– давление насыщенного пара над чистым
компонентом i;
![]() - молярная доля компонента i
в
растворе. Насыщенным называется пар,
находящийся в равновесии с жидкостью,
т.е. в стоянии, когда скорость испарения
равна скорости конденсации.
- молярная доля компонента i
в
растворе. Насыщенным называется пар,
находящийся в равновесии с жидкостью,
т.е. в стоянии, когда скорость испарения
равна скорости конденсации.
Диаграммы давление насыщенного – состав, температура – состав, состав жидкости – состав пара для идеальных растворов могут быть рассчитаны с использованием законов Рауля и Дальтона [8, 10]. На практике используются в основном диаграммы температура – состав (диаграммы перегонки) для расчетов процессов разделения и очистки жидких смесей.
Диаграммы температура – состав (T – N) могут быть получены и экспериментально на основе измерений температуры кипения растворов и чистых компонентов и определения состава равновесного с кипящей жидкостью пара. Диаграммы перегонки идеальных растворов имеют вид, подобный рис.1.
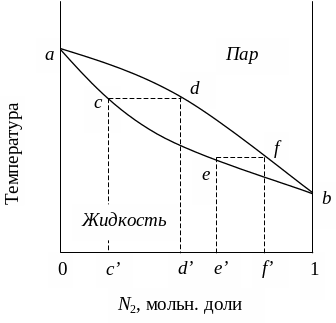
Рис. 1. Диаграмма температура кипения – состав при постоянном давлении для идеального раствора
Точки a и b на рис.1 показывают температуры кипения чистых компонентов: a – температура кипения чистого компонента 1, b – температура кипения чистого компонента 2. Ниже кривой aceb лежит область устойчивого существования одной жидкой фазы, выше кривой adfb – область устойчивого существования пара. Между кривыми aceb и adfb наблюдается такое сочетание температур и составов, при котором неустойчивая однофазная система распадается на две термодинамически устойчивые фазы – взаимно насыщенные раствор и пар. Нижняя кривая aceb изображает зависимость температуры начала кипения от состава раствора и состав жидкой фазы в двухфазной системе жидкость – пар (точки c’ и e’). Ее называют линией кипения или линией испарения. Верхняя кривая adfb показывает температуру конца кипения, т. е. температуру, при которой вся жидкость превратится в пар, и состав паровой фазы в двухфазной системе жидкость – пар (точки d’ и f’). Эта же линия показывает температуру начала конденсации пара, если насыщенный пар охлаждать состав пара при постоянном давлении. Ее называют линией конденсации.
Из рис.1. видно, что пар по сравнению с жидкостью обогащен компонентом 2, температура кипения которого ниже, т. е. пар обогащен более летучим компонентом (первый закон Коновалова-Гиббса).
Анализируя диаграмму температура – кипения состав, можно определить, какие фазы находятся в равновесии в определенном диапазоне температур и составов, температуру начала и конца кипения раствора, температуру начала и конца конденсации пара, состав жидкости и состав пара при кипении и конденсации.
