
- •Тема 9. Электрохимические процессы Оглавление
- •Тема 9. Электрохимические процессы 1
- •Основные понятия и определения
- •История развития электрохимии
- •X Луиджи Гальвани, отец современной электрофизиологии и создатель теории «животного электричества» (1737 -1798) IX столетие
- •XX столетие
- •Структура темы
- •Окислительно-восстановительные реакции
- •Понятие окислителя и восстановителя
- •Степень окисления
- •Виды окислительно-восстановительных реакций
- •Электронные и электронно-ионные уравнения
- •Окислительно-восстановительный (red-ox) потенциал
- •Условие самопроизвольного протекания red-ox процессов
- •Контрольная работа 9.1.
- •Степень окисления - ……………….
- •Процессы в гальваническом элементе
- •Гетерогенные электрохимические процессы с участием металлов. Представление о металлической связи
- •Понятие об электродном потенциале, его образование в водных растворах элекролитов
- •Образование гальванического элемента. Электродвижущая сила (эдс)
- •Электроды сравнения 1-го рода. Стандартный водородный электрод
- •Электроды сравнения 2-го рода. Хлорид-серебрянный электрод
- •Определение электродных потенциалов металлов
- •Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
- •Уравнение Нернста
- •Концентрационные гальванические элементы (кгэ)
- •Условие образования гальванического элемента
- •Поляризация в гальваническом элементе
- •8.1.3. Напряжение гальванического элемента
- •Контрольная работа 9.2.
- •Коррозия металлов
- •Коррозия в различных средах, влияние дополнительных факторов (воздействий)
- •Количественная оценка коррозии
- •Химическая коррозия
- •Электрохимическая коррозия
- •Коррозия с водородной деполяризацией
- •Коррозия с кислородной деполяризацией
- •Условие самопроизвольного протекания коррозии
- •Методы защиты от коррозии
- •Анодные и катодные покрытия
- •Протекторная защита
- •Электрозащита (катодная защита)
- •Пассиваторы, активаторы и ингибиторы коррозии
- •Электролиз
Образование гальванического элемента. Электродвижущая сила (эдс)
Гальванический элемент – это система из двух электродов, в которой одновременно самопроизвольно могут, протекать пространственно разделенные процессы окисления и восстановления, при этом во внешней цепи возникает электрический ток и совершатся полезная работа.
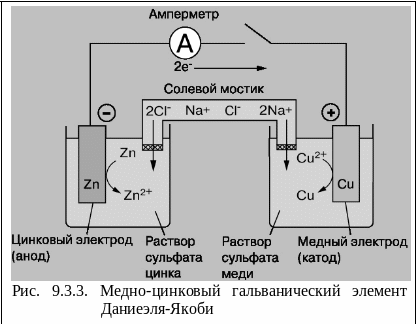
Одним из первых был создан в 1836 Дж. Даниелем простой гальванический элемент, собранный из двух электродов: цинкового, погруженного в водный раствор сульфата цинка, и медного, погруженного в водный раствор сульфата меди (II). При замкнутой внешней цепи атомы цинка на поверхности цинкового электрода окисляются до ионов с высвобождением электронов: Zn → Zn2+ + 2e-. Эти электроны перемещаются по внешней цепи на медный электрод и восстанавливают ионы меди до атомов: Cu2+ + 2e- → Cu. Поток электронов во внешней цепи - это и есть ток, вырабатываемый элементом. Суммарная реакция, приводящая к химическому превращению и протеканию электрического тока, имеет вид:
Cu2+ + Zn → Zn2+ + Cu
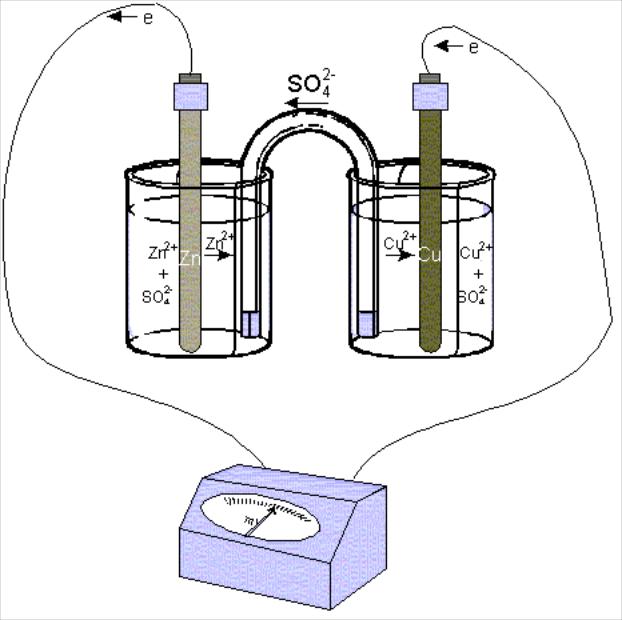
Г
Рис. 9.3.4. Лабораторная схема гальванического
элемента Даниэля-Якоби.
А(-) Zn/Zn2+//Cu2+/Cu (+)К
где А и К это металлические электроды – анод и катод соответственно.
На рис. 9.3.4. приведена лабораторная схема того же элемента. Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами. Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами. Вследствие суммарной химической реакции в ГЭ возникает электрический ток, поэтому ее называют токообразующей. При замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. (Чтобы предотвратить явление, известное как “запирание ГЭ”, т.е. дать возможность ионам соли свободно перемещаться из одного раствора в другой, используют солевой мостик. Он представляет собой изогнутую (U- образную) стеклянную трубку, заполненную насыщенным раствором хлорида калия. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится цинковая пластина (или не высадятся из раствора все ионы меди).
Разность потенциалов катода и анода гальванического элемента называется его электродвижущей силой (ЭДС) и обозначается Е или .
Электроды сравнения 1-го рода. Стандартный водородный электрод
В
Рис. 9.3.5. Схема стандартного водородного
электрода.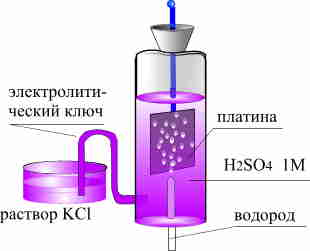
H+ + e- 1/2 H2.
