
- •Тема 9. Электрохимические процессы Оглавление
- •Тема 9. Электрохимические процессы 1
- •Основные понятия и определения
- •История развития электрохимии
- •X Луиджи Гальвани, отец современной электрофизиологии и создатель теории «животного электричества» (1737 -1798) IX столетие
- •XX столетие
- •Структура темы
- •Окислительно-восстановительные реакции
- •Понятие окислителя и восстановителя
- •Степень окисления
- •Виды окислительно-восстановительных реакций
- •Электронные и электронно-ионные уравнения
- •Окислительно-восстановительный (red-ox) потенциал
- •Условие самопроизвольного протекания red-ox процессов
- •Контрольная работа 9.1.
- •Степень окисления - ……………….
- •Процессы в гальваническом элементе
- •Гетерогенные электрохимические процессы с участием металлов. Представление о металлической связи
- •Понятие об электродном потенциале, его образование в водных растворах элекролитов
- •Образование гальванического элемента. Электродвижущая сила (эдс)
- •Электроды сравнения 1-го рода. Стандартный водородный электрод
- •Электроды сравнения 2-го рода. Хлорид-серебрянный электрод
- •Определение электродных потенциалов металлов
- •Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
- •Уравнение Нернста
- •Концентрационные гальванические элементы (кгэ)
- •Условие образования гальванического элемента
- •Поляризация в гальваническом элементе
- •8.1.3. Напряжение гальванического элемента
- •Контрольная работа 9.2.
- •Коррозия металлов
- •Коррозия в различных средах, влияние дополнительных факторов (воздействий)
- •Количественная оценка коррозии
- •Химическая коррозия
- •Электрохимическая коррозия
- •Коррозия с водородной деполяризацией
- •Коррозия с кислородной деполяризацией
- •Условие самопроизвольного протекания коррозии
- •Методы защиты от коррозии
- •Анодные и катодные покрытия
- •Протекторная защита
- •Электрозащита (катодная защита)
- •Пассиваторы, активаторы и ингибиторы коррозии
- •Электролиз
Уравнение Нернста
Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных условиях, можно рассчитать по уравнению Нернста:
![]()
где: φ - электродный потенциал окислительно-восстановительного электрода, В;
φ0 - стандартный электродный потенциал этого электрода, В, R - универсальная газовая постоянная, равная 8,314 Дж/моль· К, T – температура в K; n - число электронов в уравнении электродной реакции, F - число Фарадея, равное 96500 Кл/моль, ок., восст. - активности окисленной формы восстановителя (Меn+) и восстановленной формы окислителя (Ме) в электродной реакции. Подставив в уравнение Нернста T = 298 K, R, F и введя множитель 2,3 (переход к десятичным логарифмам), получим:
![]()
Уравнение Нернста для металлического электрода имеет вид:

Для разбавленных растворов, в которых активности мало отличаются от концентрации (a С):
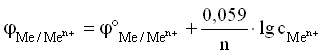
Величина Men+/Me0 называется стандартным ЭП металлического электрода. Значение ЭП металлического электрода равно величине стандартного ЭП металлического электрода при концентрации ионов металла в растворе, равной 1 моль/л. Стандартный электродный потенциал – равновесная разность потенциалов гальванического элемента, составленного из стандартного водородного электрода (электрод сравнения) и электрода, потенциал которого определяется в стандартных условиях.
Концентрационные гальванические элементы (кгэ)
Гальванический элемент составленный из электродов одного и того же металла, но опущенных в растворы с разной концентрацией его ионов называется концентрационным. Примером такого элемента является ГЭ, в котором анодом будет хлорид-серебряный электрод, а катодом стандартный серебряный электрод:
А(-) Ag/AgCl, Cl-//Ag+/ Ag (+)К
Потенциал стандартного серебряного электрода равен EAg+/Ag0 = 0,8 В, а потенциал хлорид-серебряного электрода EAgCl/Ag+Cl- = 0,224 В. Определим значение ЭДС:
Е = Е0Ag+/Ag0 - EAgCl/Ag0+Cl- = 0,8 – 0,224 = 0,556 В/
ЭДС КГЭ зависит от разности концентраций ионов металла около катода и анода, чем она больше, тем выше значение ЭДС.
ЕКГЭ = RT/nF ln(αMen+k/αMen+a) = 0,059/n lg(cMen+k/cMen+a)
Условие образования гальванического элемента
Возникновение ГЭ возможно в том случае, который мы рассматривали в разделе 9.2.6. Поскольку в процессы в ГЭ являются окислительно-востановительными, то условием их самопроизвольного протекания будет:
G=-Амах = - qЕ,
где Е – разность потенциалов катода и анода, тогда условием самопроизвольного образования ГЭ будет:
ΔЕ = Ек – Еа > 0 или Ек > Еа
Таким образом, оказывается, что чем выше разность потенциалов ГЭ тем он более термодинамически выгоден. При составлении схемы ГЭ определяют значения потенциалов электродов в данных условиях (в основном на величину потенциала влияет концентрация ионов металла) затем выбирают электрод с большим потенциалом – катодом, с меньшим - анодом. Один и тот же электрод, в зависимости от того с кем он в паре, может быть анодом или катодом. Примером является хлорид-серебряный электрод сравнения, который в паре с цинковым электродом является катодом, а с медным электродом – анодом.
