
- •Тема 9. Электрохимические процессы Оглавление
- •Тема 9. Электрохимические процессы 1
- •Основные понятия и определения
- •История развития электрохимии
- •X Луиджи Гальвани, отец современной электрофизиологии и создатель теории «животного электричества» (1737 -1798) IX столетие
- •XX столетие
- •Структура темы
- •Окислительно-восстановительные реакции
- •Понятие окислителя и восстановителя
- •Степень окисления
- •Виды окислительно-восстановительных реакций
- •Электронные и электронно-ионные уравнения
- •Окислительно-восстановительный (red-ox) потенциал
- •Условие самопроизвольного протекания red-ox процессов
- •Контрольная работа 9.1.
- •Степень окисления - ……………….
- •Процессы в гальваническом элементе
- •Гетерогенные электрохимические процессы с участием металлов. Представление о металлической связи
- •Понятие об электродном потенциале, его образование в водных растворах элекролитов
- •Образование гальванического элемента. Электродвижущая сила (эдс)
- •Электроды сравнения 1-го рода. Стандартный водородный электрод
- •Электроды сравнения 2-го рода. Хлорид-серебрянный электрод
- •Определение электродных потенциалов металлов
- •Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
- •Уравнение Нернста
- •Концентрационные гальванические элементы (кгэ)
- •Условие образования гальванического элемента
- •Поляризация в гальваническом элементе
- •8.1.3. Напряжение гальванического элемента
- •Контрольная работа 9.2.
- •Коррозия металлов
- •Коррозия в различных средах, влияние дополнительных факторов (воздействий)
- •Количественная оценка коррозии
- •Химическая коррозия
- •Электрохимическая коррозия
- •Коррозия с водородной деполяризацией
- •Коррозия с кислородной деполяризацией
- •Условие самопроизвольного протекания коррозии
- •Методы защиты от коррозии
- •Анодные и катодные покрытия
- •Протекторная защита
- •Электрозащита (катодная защита)
- •Пассиваторы, активаторы и ингибиторы коррозии
- •Электролиз
Контрольная работа 9.1.
Окислительно-восстановительная реакция ЭТО – ……..
Перечислите основные виды окислительно-восстановительных реакций.
Степень окисления - ……………….
Определите степени окисления элементов в следующих соединениях: N2O5; K2Cr2O7; C2H5OH; N2H4; H2ClO3; O3; Na2AlO3; C4H8; C2H5NO2; Fe3(MnO4)2.
Восстановитель ЭТО - ….. Из следующих соединений выберете только окислители, восстановители и вещества которые могут проявлять и те и другие свойства: НF; HNO3; H2SO4; O3; Na2AlO3; N2O5; K2Cr2O7; Fe3(MnO4)2; F2; H2O.
Red-ox потенциал это - ……… Что и как определяют Red-ox потенциалы? Запишите условие самопроизвольного протекания окислительно-восстановительных реакций.
Составьте электронно-ионные уравнения и расставьте коэффициенты в реакции взаимодействия K2Cr2O7 с FeCl2 в присутствии H2SO4.
Процессы в гальваническом элементе
Электрохимические процессы в гальваническом элементе это окислительно-восстановительные реакции, как правило, протекающие на поверхности металлов находящихся в водном растворе собственных ионов. При этом процессы окисления и восстановления оказываются пространственно разделенными.
Гетерогенные электрохимические процессы с участием металлов. Представление о металлической связи
Рассмотрим процессы, протекающие при погружении металла в раствор собственных ионов. Металлы имеют кристаллическое строение. В узлах решеток расположены ион-атомы, находящиеся в равновесии со свободными электронами:
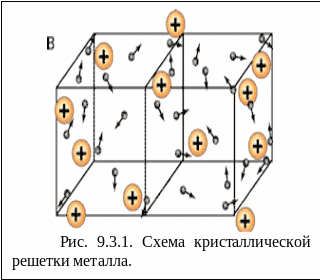
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной реакцией является взаимодействие поверхностных ион-атомов металла, находящихся в узлах решетки, с полярными молекулами растворителя (воды), ориентированными у поверхности электрода. В результате указанного процесса происходит окисление металла, и его сольватированные (гидратированные) ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле:
Me + mH2O - ne-↔ Me.(H2O)mn+
Понятие об электродном потенциале, его образование в водных растворах элекролитов
В случае если металл активный (достаточно сильный восстановитель) ионы с поверхности переходят в раствор и металл становится заряженным отрицательно, а раствор - положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл - раствор возникает двойной электрический слой (рис.9.3.2).
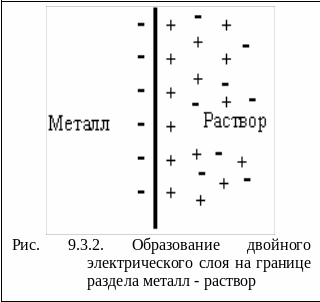
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом (ЭП) и обозначается ЕMen+/Me0. По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует дальнейшему окислению металла. Наряду с этой реакцией протекает обратная реакция - восстановление ионов металла до атомов.
![]()
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала (ЕMen+/Me0) скорость прямого процесса будет равна скорости обратного процесса. При этом устанавливается равновесие:
Me + mH2O - ne-↔ Me(H2O)mn+
Для упрощения гидратационную воду обычно в уравнение реакции не включают и его записывают в виде:
Me + ne-↔ Men+
Равновесие имеет динамический характер, т.е. процессы при равновесии идут с одинаковой скоростью в прямом и обратном направлениях. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Абсолютные значения ЭП экспериментально определить невозможно. Однако можно определить их разность. Для характеристики электродных процессов пользуются относительными значениями ЭП. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого определен. Такие электроды называются электродами сравнения.
