
- •Тема 9. Электрохимические процессы Оглавление
- •Тема 9. Электрохимические процессы 1
- •Основные понятия и определения
- •История развития электрохимии
- •X Луиджи Гальвани, отец современной электрофизиологии и создатель теории «животного электричества» (1737 -1798) IX столетие
- •XX столетие
- •Структура темы
- •Окислительно-восстановительные реакции
- •Понятие окислителя и восстановителя
- •Степень окисления
- •Виды окислительно-восстановительных реакций
- •Электронные и электронно-ионные уравнения
- •Окислительно-восстановительный (red-ox) потенциал
- •Условие самопроизвольного протекания red-ox процессов
- •Контрольная работа 9.1.
- •Степень окисления - ……………….
- •Процессы в гальваническом элементе
- •Гетерогенные электрохимические процессы с участием металлов. Представление о металлической связи
- •Понятие об электродном потенциале, его образование в водных растворах элекролитов
- •Образование гальванического элемента. Электродвижущая сила (эдс)
- •Электроды сравнения 1-го рода. Стандартный водородный электрод
- •Электроды сравнения 2-го рода. Хлорид-серебрянный электрод
- •Определение электродных потенциалов металлов
- •Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
- •Уравнение Нернста
- •Концентрационные гальванические элементы (кгэ)
- •Условие образования гальванического элемента
- •Поляризация в гальваническом элементе
- •8.1.3. Напряжение гальванического элемента
- •Контрольная работа 9.2.
- •Коррозия металлов
- •Коррозия в различных средах, влияние дополнительных факторов (воздействий)
- •Количественная оценка коррозии
- •Химическая коррозия
- •Электрохимическая коррозия
- •Коррозия с водородной деполяризацией
- •Коррозия с кислородной деполяризацией
- •Условие самопроизвольного протекания коррозии
- •Методы защиты от коррозии
- •Анодные и катодные покрытия
- •Протекторная защита
- •Электрозащита (катодная защита)
- •Пассиваторы, активаторы и ингибиторы коррозии
- •Электролиз
Условие самопроизвольного протекания red-ox процессов
В большинстве случаев химикам приходится отвечать на вопрос: возможно ли протекание окислительно-восстановительной реакции между данным реагентами, а если возможно, то какова полнота протекания такой реакции? Решению данной проблемы, часто вызывающей затруднения, посвящен этот параграф.
Известно, что не всякий окислитель в состоянии окислить данную восстановленную форму. Так, диоксид свинца PbO2 легко окисляет бромид-ион в кислой среде по реакции
PbO2 + 2Br– + 4H+ = Pb2+ + Br2 + 2H2O,
реакция окисления бромид-иона катионом железа(III)
2Fe3+ + 2Br– ≠ 2Fe2+ + Br2
не протекает.
Рассмотрев несколько подобных примеров, легко заключить, что различные окислители могут сильно отличаться друг от друга по своей окислительной (окисляющей) способности. Аналогичный вывод справедлив, разумеется, и по отношению к восстановителям.
Окислительная (восстановительная) способность данного окислителя (восстановителя) часто существенно зависит от условий проведения реакции, в частности, от кислотности среды. Так, бромат-ион легко окисляет бромид-ион
BrO3– + 5Br– + 6H+ = 3Br2 + 3H2O,
если кислотность достаточно высока, но окисление не происходит в слабокислотной и тем более в нейтральной или щелочной среде.
Источником наших знаний об окислительной способности различных окислителей, восстановительной способности восстановителей, влиянии кислотности среды на протекание ОВР и т.п. в конечном счете является опыт. Речь, конечно, идет не столько о нашем собственном опыте, который всегда ограничен, сколько о совокупном опыте многих поколений химиков, который к настоящему времени привел к созданию строгой и законченной количественной теории окислительно-восстановительных реакций, находящейся в полном соответствии с самыми точными экспериментами.
Термодинамическая теория ОВР использует результаты измерения электродных потенциалов и их строгого термодинамического расчета для однозначного ранжирования окислителей и восстановителей по их силе и формулирует точные уравнения, позволяющие заранее предсказать возможность и полноту протекания данной реакции в данных условиях.
При этом предполагается, что реакции на межфазных границах протекают достаточно быстро, а в объеме раствора – практически мгновенно. В неорганической химии, где реакции часто протекают с участием ионов, это предположение почти всегда оправдано (отдельные примеры термодинамически возможных реакций, которые на самом деле не протекают из-за кинетических затруднений, будут рассмотрены ниже).
При изучении ОВР в общей и неорганической химии одной из наших задач является обучение студентов осознанному применению простых качественных критериев самопроизвольного протекания ОВР в том или ином направлении в стандартных условиях и полноты их протекания в реально используемых в химической практике условиях (без учета возможных кинетических затруднений).
Прежде всего зададимся таким вопросом: от чего зависит окислительная способность окислителя, участвующего в той или иной полуреакции, например,
MnO4– + 8H+ + 5e = Mn2+ + 4H2O ?
Хотя при записи уравнений полуреакций и ионных уравнений ОВР в целом мы по традиции пользуемся знаком равенства, а не знаком обратимости, в действительности все реакции в той или иной степени химически обратимы, и поэтому в состоянии равновесия с равными скоростями всегда протекают и прямая и обратная реакции. Повышение концентрации окислителя MnO4– увеличивает, как известно из школьного курса химии, скорость прямой реакции, т.е. приводит к сдвигу равновесия вправо; при этом полнота окисления восстановителя повышается. К такому же выводу, естественно, приводит и использование принципа Ле-Шателье. Таким образом, окислительная способность окислителя всегда увеличивается с ростом его концентрации. Этот вывод представляется достаточно тривиальным и почти самоочевидным. Однако, рассуждая точно таким же способом, мы можем заключить, что окислительная способность перманганат-иона в кислотной среде увеличится при увеличении концентрации ионов водорода и уменьшится при увеличении концентрации катиона Mn 2+ (в частности, при его накоплении в растворе по мере протекания реакции). В общем случае окислительная способность окислителя зависит от коцентраций всех фигурирующих в уравнении полуреакции частиц. При этом ее повышению, т.е. процессу восстановления окислителя способствует увеличение концентрации частиц в левой части полуреакции; повышение же концентрации частиц в ее правой части, напротив, препятствует этому процессу.
Точно такие же выводы могут быть сделаны и в отношении полуреакций окисления восстановителя и окислительно-восстановительных реакций в целом (если они записаны в ионном виде).
Количественной мерой окислительной способности окислителя (и одновременно восстановительной способностиего восстановленной формы) является электрический потенциал электрода φ (электродный потенциал), на котором одновременно и с равными скоростями протекают полуреакция его восстановления и обратная ей полуреакция окисления соответствующей восстановленной формы. Этот окислительно-восстановительный потенциал измеряется по отношению к стандартному водородному электроду и характеризует пару «окисленная форма – восстановленная форма» (поэтому выражения «потенциал окислителя» и «потенциал восстановителя», строго говоря, неверны). Чем выше потенциал пары, тем сильнее выражена окислительная способность окислителя и, соответственно, слабее – восстановительная способность восстановителя. И напротив: чем ниже потенциал (вплоть до отрицательных значений), тем сильнее выражены восстановительные свойства восстановленной формы и слабее - окислительные свойства сопряженного с ней окислителя. Типы электродов, конструкция стандартного водородного электрода и методы измерения потенциалов детально рассматриваются в курсе физической химии.
Уравнение Нернста
Зависимость окислительно-восстановительного потенциала, отвечающего полуреакции восстановления перманганат-иона в кислой среде (и, как уже отмечалось, одновременно полуреакции окисления катиона Mn2+ до перманганат-иона в кислой среде) от перечисленных выше определяющих его факторов количественно описывается уравнением Нернста
φ(MnO4–, H+ / Mn2+) = φo(MnO4–, H+ / Mn2+) + RT / 5Fln[MnO4–][H+]8 / [Mn2+].
В общем случае уравнение Нернста принято записывать в так:
φ(Ox/Red) =
φo(Ox/Red)
+ RT/(nF)
ln [Ox]/[Red],
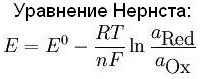
отвечающей записи полуреакции восстановления окислителя
Ox + ne- = Red
Каждая из концентраций под знаком натурального логарифма в уравнении Нернста возводится в степень, соответствующую стехиометрическому коэффициенту данной частицы в уравнении полуреакции, n – число принимаемых окислителем электронов, R – универсальная газовая постоянная, T – температура, F – число Фарадея.
Измерить окислительно-восстановительный потенциал в реакционном сосуде во время протекания реакции, т.е. в неравновесных условиях, невозможно, так как при измерении потенциала электроны должны передаваться от восстановителя к окислителю не непосредственно, а через соединяющий электроды металлический проводник. При этом скорость передачи электронов (силу тока)нужно поддерживать очень малой за счет приложения внешней (компенсирующей) разности потенциалов. Иначе говоря, измерение электродных потенциалов возможно только в равновесных условиях, когда прямой контакт между окислителем и восстановителем исключен.Поэтому квадратными скобками в уравнении Нернста обозначены, как обычно, равновесные (в условиях измерения) концентрации частиц. Хотя потенциалы окислительно-восстановительных пар во время протекания реакции нельзя измерить, их можно вычислить, подставляя в уравнение Нернста текущие, т.е. отвечающие данному моменту времени концентрации. Если рассматривается изменение потенциала по мере протекания реакции, то сначала это начальные концентрации, затем концентрации, зависящие от времени, и, наконец, после прекращения реакции, равновесные. По мере протекания реакции вычисляемый по уравнению Нернста потенциал окислителя уменьшается, а отвечающий второй полуреакции потенциал восстановителя, напротив, увеличивается. Когда эти потенциалы выравниваются, реакция прекращается, и система приходит в состояние химического равновесия.
Критерий направления реакции в стандартных условиях.
Если в реакционной смеси присутствуют как исходные вещества, так и образуемые ими при протекании ОВР продукты реакции или, иначе говоря, два окислителя и два восстановителя, то направление реакции определяется тем, какой из окислителей в данных условиях в соответствии с уравнением Нернста окажется более сильным. Особенно просто определяется направление реакции в стандартных условиях, когда все участвующие в ней вещества (частицы) находятся в своих стандартных состояниях.
Из термодинамики следует, что любой процесс может протекать самопроизвольно при определенных внешних условиях когда выполняется соотношение G < 0. Поскольку G=-Амах, а работа по переносу заряда равна Амах=qφ, q = nF – переносимый заряд, φ – разность потенциалов, то условие самопроизвольного протекания ред-окс процессов оказывается:
G=- qφ< 0 откуда следует Δφо = φоОк – φовос> 0 или φоОк > φовос
Более сильным в этих условиях, очевидно, оказывается окислитель той пары, которая характеризуется более высоким стандартным потенциалом. Хотя направление реакции в стандартных условиях этим однозначно определено, мы, заранее не зная его, можем написать уравнение реакции или правильно (реакция в стандартных условиях действительно идет в принятом нами, т.е. в прямом направлении) или неправильно (реакция идет в обратном принятому нами направлении). Любая запись уравнения ОВР предполагает определенный выбор окислителя в левой части уравнения. Если в стандартных условиях этот окислитель сильнее, реакция пойдет в прямом направлении, если нет – в обратном. Стандартный потенциал окислительно-восстановительной пары, в которой окисленной формой является выбранный нами окислитель, назовем потенциалом окислителя φоОк, а стандартный потенциал другой пары, в которой восстановленной формой является выбранным нами восстановитель – потенциалом восстановителя φоВс.
Величину Δφо = φоОк – φоВс назовем стандартной разностью окислительно-восстановительных потенциалов. После введения этих обозначений критерию направления реакции в стандартных условиях можно придать простой вид:
Если Δφо > 0, реакция в стандартных условиях протекает в прямом направлении; если Δφо < 0, то в обратном.
В действительности в стандартных условиях реакции никогда не проводят, хотя бы уже потому, что продукты реакции в реакционной смеси первоначально отсутствуют. Даже если мы специально захотим провести реакцию в стандартных условиях, это окажется нелегким делом. Действительно, пусть мы каким-то образом обеспечили стандартные условия реакции (т.е. стандартные состояния всех участвующих в ней веществ) в первый момент времени.Но как только реакция начнется, условия перестанут быть стандартными, поскольку все концентрации изменятся. Тем не менее мысленно мы можем представить себе течение реакции в стандартных условиях. Для этого нужно считать объем реакционной смеси очень большим (в пределе - бесконечно большим), тогда концентрации веществ при протекании реакции изменяться не будут.
Действительный смысл этого критерия состоит в сопоставлении силы двух окислителей в стандартных условиях: если Δφо> 0, то окислитель в левой части ионного уравнения ОВР сильнее второго окислителя в правой части уравнения.
Критерий полноты ОВР (или критерий химической необратимости ОВР)
Степень полноты протекающей в прямом направлении реакции при Δφо > 0 зависит от величины Δφо. Чтобы реакция протекала практически нацело или "до конца", т.е. до исчерпания по меньшей мере одной из исходных частиц (ионов, молекул), или, иначе говоря, чтобы она была химически необратимой, нужно, чтобы разность стандартных потенциалов была достаточно велика. Заметим, что любая реакция, независимо от ее химической обратимости, всегда термодинамически необратима, если она протекает в пробирке или ином химическом реакторе, т.е. вне обратимого гальванического элемента или иного специального устройства).
Авторы ряда пособий критерием полноты ОВР считают условие Δφо > 0,1 В. Для многих реакций это условие правильно, однако полнота ОВР (точнее – степень протекания реакции) при заданном значении Δφо зависит от стехиометрических коэффициентов в ее ионном уравнении, а также от начальных концентраций реагентов. Расчеты с применением уравнения Нернста, позволяющего найти константу равновесия ОВР, и закона действующих масс показывают, что реакции заведомо химически необратимы при Δφо > 0,4. В этом случае реакция всегда, т.е. при любых начальных условиях (о стандартных условиях теперь речь, разумеется, не идет), проходит в прямом направлении до конца. Совершенно аналогичным образом, если Δφо < – 0,4 В, реакция всегда протекает до конца, но в обратном направлении. Изменять направление и полноту протекания таких реакций, т.е. управлять ими, при всем желании невозможно, в отличие от химически обратимых реакций, для которых 0,4< Δφо < 0,4 В
В первом случае в стандартных условиях реакция всегда протекает в прямом направлении. Это означает, что в отсутствие продуктов реакции в начальный момент времени реакция тем более (т.е. тоже всегда) будет протекать в прямом направлении, но не до конца. Более полному протеканию реакции способствуют избыток одного или нескольких реагентов и вывод из сферы реакции тем или иным способом ее продуктов. Часто удается добиться достаточно полного протекания таких реакций несмотря на их химическую обратимость. С другой стороны, обычно можно также создать условия, при которых такая реакция будет протекать в обратном направлении. Для этого надо создать высокие концентрации "реагентов" (до сих пор мы считали их продуктами реакции), начинать реакцию в отсутствии ее "продуктов" (т.е. реагентов, при прямом течении реакции) и стараться поддерживать по возможности низкую их концентрацию в ходе реакции.
Таким же образом в общем виде можно рассмотреть и химически обратимые ОВР с Δφо < 0. Вместо этого обсудим возможности управления конкретной химической реакцией
Cu(т) + 2H2SO4 = CuSO4 + SO2(г) + 2H2O
или в ионном виде:
Cu(т) + 4H+ + SO42-= Cu2+ + SO2(г) + 2H2O
с Δφо = – 0,179 В. В стандартных условиях, когда концентрации ионов H+, SO42-, Cu2+ в водном растворе равны 1 моль/л, а давление SO2 составляет 1 атм, эта реакция протекает в обратном направлении, т.е. диоксид серы восстанавливает катион Cu2+ до порошка металлической меди. Заметим, во-первых, что ни о какой концентрированной серной кислоте речь пока не идет. Во-вторых, создать раствор со стандартными концентрациями ионов, используя только серную кислоту и сульфат меди, невозможно, и если бы мы захотели решить эту задачу (а зачем?) пришлось бы применять другие комбинации веществ, например, NaHSO4 + CuCl2 или HCl + CuSO4, пренебрегая возможным влиянием хлорид-ионов на ход реакции. Реакции восстановления катионов меди способствуют повышение давления SO2 и вывод из сферы реакции ионов H+ и SO42- (например, при добавлении Ba(OH)2, Ca(OH)2 и т.п.). При этом может быть достигнута высокая – близкая к 100% – полнота восстановления меди. С другой стороны, повышение концентрации серной кислоты, отвод из сферы реакции диоксида серы и воды или связывание последней иным образом способствуют протеканию прямой реакции, и уже в ходе выполнения первой лабораторной работы студенты могут непосредственно наблюдать взаимодействие меди с концентрированной серной кислотой с выделением диоксида серы. Поскольку реакция протекает только на границе раздела фаз, скорость ее невелика. Подобные гетерогенные (точнее было бы сказать – гетерофазные) реакции всегда лучше (в смысле – быстрее) идут при нагревании. Влияние температуры на стандартные потенциалы невелико и обычно не рассматривается.
Таким образом, обратимые ОВР могут быть проведены как в прямом, так и в обратном направлениях. По этой причине их иногда называют двусторонними, и надо признать этот не получивший, к сожалению, широкого распространения термин более удачным, тем более, что он исключает затруднения, возникающие из-за созвучности не имеющих между собой ничего общего понятий химической и термодинамической обратимости и необратимости (студенту трудно понять, что любая химически обратимая реакция в обычных условиях протекает термодинамически необратимо, но без этого понимания ему почти недоступен истинный смысл многих разделов химической термодинамики).Отметим еще, что в обоих направлениях обратимые ОВР протекают самопроизвольно (или, иначе говоря, термодинамически необратимо), как и любые другие химические реакции. Несамопроизвольные ОВР протекают только при электролизе или зарядке аккумуляторов. Поэтому, возможно, правильнее было бы не упоминать мимоходом о самопроизвольном протекании реакций в том или ином направлении, а место этого глубже проанализировать сами понятия самопроизвольного и несамопроизвольного процессов.
Кинетические затруднения при взаимодействии ионов
Как уже отмечалось, протекающие во всем объеме раствора реакции с участием ионов почти всегда протекают очень быстро. Однако имеются и исключения. Так, реакция окисления катиона аммония в кислой среде катионом железа(III)
6Fe3+ + 2NH4 + ≠ N2 + 6Fe2+ + 8H+
термодинамически возможна (Δφо = 0,499 В), но на самом деле не идет.
Причиной кинетических затруднений здесь является кулоновское отталкивание катионов окислителя и восстановителя, мешающее им подойти друг к другу на расстояние, при котором возможен электронный переход. По аналогичной причине (но уже из-за кулоновского отталкивания анионов) не происходит окисление иодид-иона нитрат-ионом в кислой среде, хотя для этой реакции Δφо = 0,420 В.
После добавления цинка в системе появляются нейтральные молекулы азотистой кислоты, которым ничто не мешает окислить иодид-ионы.
Рекомендуемые упражнения
1. Не прибегая к справочным данным, установите в какой среде (кислой или щелочной) полнее протекают следующие окислительно-восстановительные реакции:
а) Cl0 → Cl–I + Cl+I
б) Br0 → Br–I + Br+V..
Подтвердите ответ расчетом Δφ0 этих реакций в кислой и щелочной средах.
2. Укажите стандартные состояния частиц, участвующих в следующих окислительно-восстановительных реакциях (стандартные условия ОВР) и направление этих реакций в стандартных условиях:
а) 2KMnO4 + 3H2O2 = 2MnO2(т) + 3O2(г) +2H2O + 2KOH
б) Br2(p) + SO2(г) + 2H2O = 2HBr + H2SO4
в) 2Al(т) + 2NaOH +6H2O = 2Na[Al(OH)4] + 3H2(г)
г) 2Сr3+ + 6CO2(г) + 15H2O = Cr2O72– + 8H3O+ + 3H2C2O4.
3. В каком виде Fe(III) является более сильным окислителем – в виде катиона Fe 3+ или в виде аниона [Fe(CN)6]3–? Восстановленные формы – Fe2+ и [Fe(CN)6]4–, соответственно.
4. В каком виде Сo(II) проявляет более сильные восстановительные свойства – в виде катиона Сo2+ или катиона [Co(NH3)6]2+? Окисленные формы – Сo3+ и [Co(NH3)6]3+, соответственно.
5. Можно ли использовать дихромат калия в качестве окислителя для осуществления следующих процессов в кислой среде:
а) 2 F– – 2e- = F2
б) 2Br– – 2e- = Br2
в) HNO2 +H2O – 2e- = NO3–+ 3H+
г) Mn2+ + 4H2O – 5e- = MnO4– + 8H+
д) H2S – 2e- = S + 2H+.
6. Установите, можно ли приготовить водный раствор, содержащий одновременно следующие вещества:
а) перманганат калия и сульфит калия
б) перманганат калия и сульфат калия
в) [Cr(OH)6]3– и Br2
г) KNO2 и HI
д) H2SO4 и HCl.
Если ответ отрицателен, подтвердите его уравнением ОВР.
http://www.alhimik.ru/cafedra/consult/ovr.htm
Разработка составлена проф. В.А. Михайловым и ст. преп. Л.И. Покровской в соответствии с решением кафедры неорганической химии МИТХТ им. М.В. Ломоносова.
