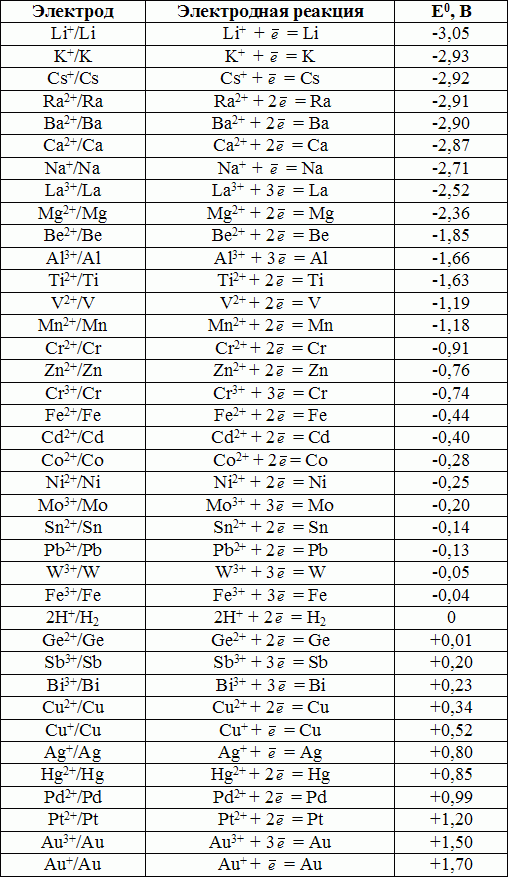- •Тема 9. Электрохимические процессы Оглавление
- •Тема 9. Электрохимические процессы 1
- •Основные понятия и определения
- •История развития электрохимии
- •X Луиджи Гальвани, отец современной электрофизиологии и создатель теории «животного электричества» (1737 -1798) IX столетие
- •XX столетие
- •Структура темы
- •Окислительно-восстановительные реакции
- •Понятие окислителя и восстановителя
- •Степень окисления
- •Виды окислительно-восстановительных реакций
- •Электронные и электронно-ионные уравнения
- •Окислительно-восстановительный (red-ox) потенциал
- •Условие самопроизвольного протекания red-ox процессов
- •Контрольная работа 9.1.
- •Степень окисления - ……………….
- •Процессы в гальваническом элементе
- •Гетерогенные электрохимические процессы с участием металлов. Представление о металлической связи
- •Понятие об электродном потенциале, его образование в водных растворах элекролитов
- •Образование гальванического элемента. Электродвижущая сила (эдс)
- •Электроды сравнения 1-го рода. Стандартный водородный электрод
- •Электроды сравнения 2-го рода. Хлорид-серебрянный электрод
- •Определение электродных потенциалов металлов
- •Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
- •Уравнение Нернста
- •Концентрационные гальванические элементы (кгэ)
- •Условие образования гальванического элемента
- •Поляризация в гальваническом элементе
- •8.1.3. Напряжение гальванического элемента
- •Контрольная работа 9.2.
- •Коррозия металлов
- •Коррозия в различных средах, влияние дополнительных факторов (воздействий)
- •Количественная оценка коррозии
- •Химическая коррозия
- •Электрохимическая коррозия
- •Коррозия с водородной деполяризацией
- •Коррозия с кислородной деполяризацией
- •Условие самопроизвольного протекания коррозии
- •Методы защиты от коррозии
- •Анодные и катодные покрытия
- •Протекторная защита
- •Электрозащита (катодная защита)
- •Пассиваторы, активаторы и ингибиторы коррозии
- •Электролиз
Электроды сравнения 2-го рода. Хлорид-серебрянный электрод
Поскольку свэ является достаточно сложным устройством в лабораторных условиях чаще применяют более удобные в работе электроды сравнения второго рода, имеющие определенное и неизменяемое значение потенциала. Обычно пользуются хлорид-серебрянным и каломельным электродом (КЭ), состоящим из металлической ртути, хлорида ртути (каломели), находящейся в насыщенном растворе и 1 молярного раствора хлорида калия: Hg/Hg2Cl2/KCl. На электроде протекает следующая реакция:
Hg2Cl2 + 2е- = 2Hg + 2Cl-
Потенциал КЭ не зависит от концентрации ионов ртути, поскольку она очень мала и при работе ГЭ не изменяется. Значение потенциала КЭ при стандартных условиях: EКЭ = 0,2412 В и практически не меняется в ходе проводимых измерений. Аналогичным электродом сравнения 2-го рода является и хлорид-серебрянный электрод, для которого характерно равновесие:
AgCl + е- Ag + Cl-
Значение потенциала такого электрода EAgCl/Ag+Cl- = 0,224 В.
Определение электродных потенциалов металлов
Электродные потенциалы экспериментально определяют, измеряя напряжение гальванического элемента, составленного из исследуемого и электрода сравнения, потенциал которого известен. Схему элемента, в котором электродом сравнения является водородный электрод, записывают следующим образом: слева - водородный электрод, справа - измеряемый электрод.
Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид:
H2, Pt | H+ || Zn2+ | Zn,
а схема элемента для измерения потенциала медного электрода:
H2, Pt | H+ || Cu2+ | Cu,
напряжение гальванического элемента равно разности потенциалов правого и левого электродов:
![]()
Так как потенциал левого электрода условно принимают равным нулю, то напряжение измеряемого элемента будет равно потенциалу правого электрода для водородно-цинкового элемента с обратным знаком:
Е = ЕH+/H0 - ЕZn2+/Zn0 –= 0,763 В,
т.е. водородный электрод будет катодом, а – цинковый анодом, во внешней цепи электроны будут перемещаются от цинкового электрода к водородному. Для медно-водородного электрода:
Е = ЕCu2+/Cu0 - ЕH+/H0 = 0,337 В,
медный электрод заряжен, относительно водородного, более положительно. Таким образом, во внешней цепи электроны перемещаются от водородного электрода к медному.
Теперь, зная потенциалы цинкового и медного электродов, можем рассчитать напряжение для элемента Даниэля-Якоби:
Е = ЕCu2+/Cu0 - ЕZn2+/Zn0 = + 0,337 –(-0,763) = 1,1 В,
Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
Стандартные электродные потенциалы металлических электродов в водных растворах приведены в справочной литературе. Величины стандартных ЭП металлов являются мерой восстановительной способности их атомов и мерой окислительной способности ионов металлов. Чем более отрицательное значение имеет потенциал системы Ме/Меn+, тем более сильной восстановительной способностью обладает атом. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. Например, к наиболее сильным восстановителям (в водном растворе) относится литий (ЕLi+/Li0 = -3,04 B), а к наиболее сильным окислителям - ионы золота Au3+, Au+ (ЕAu3+/Au0 = +1,50 B, ЕAu+/Au0 = +1,69 B).
В таблице 9.1. приведены значения некоторых стандартных электродных потенциалов.
Полученный ряд значений получил условное название «ряд напряжений». В этом ряду металлы располагаются по мере уменьшения металлических свойств.
Таблица 9.1. Стандартные электродные потенциалы металлов.