
- •Тема 9. Электрохимические процессы Оглавление
- •Тема 9. Электрохимические процессы 1
- •Основные понятия и определения
- •История развития электрохимии
- •X Луиджи Гальвани, отец современной электрофизиологии и создатель теории «животного электричества» (1737 -1798) IX столетие
- •XX столетие
- •Структура темы
- •Окислительно-восстановительные реакции
- •Понятие окислителя и восстановителя
- •Степень окисления
- •Виды окислительно-восстановительных реакций
- •Электронные и электронно-ионные уравнения
- •Окислительно-восстановительный (red-ox) потенциал
- •Условие самопроизвольного протекания red-ox процессов
- •Контрольная работа 9.1.
- •Степень окисления - ……………….
- •Процессы в гальваническом элементе
- •Гетерогенные электрохимические процессы с участием металлов. Представление о металлической связи
- •Понятие об электродном потенциале, его образование в водных растворах элекролитов
- •Образование гальванического элемента. Электродвижущая сила (эдс)
- •Электроды сравнения 1-го рода. Стандартный водородный электрод
- •Электроды сравнения 2-го рода. Хлорид-серебрянный электрод
- •Определение электродных потенциалов металлов
- •Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
- •Уравнение Нернста
- •Концентрационные гальванические элементы (кгэ)
- •Условие образования гальванического элемента
- •Поляризация в гальваническом элементе
- •8.1.3. Напряжение гальванического элемента
- •Контрольная работа 9.2.
- •Коррозия металлов
- •Коррозия в различных средах, влияние дополнительных факторов (воздействий)
- •Количественная оценка коррозии
- •Химическая коррозия
- •Электрохимическая коррозия
- •Коррозия с водородной деполяризацией
- •Коррозия с кислородной деполяризацией
- •Условие самопроизвольного протекания коррозии
- •Методы защиты от коррозии
- •Анодные и катодные покрытия
- •Протекторная защита
- •Электрозащита (катодная защита)
- •Пассиваторы, активаторы и ингибиторы коррозии
- •Электролиз
Окислительно-восстановительный (red-ox) потенциал
Окислительно-восстановительный потенциал (ОВП), называемый также редокс-потенциал (от английского RedOx - Reduction/Oxidation), характеризует «силу» окислителя и восстановителя в окислительно-восстановительных реакциях, т.е. реакциях, связанных с присоединением или передачей электронов.
Значение окислительно-восстановительного потенциала для каждой окислительно-восстановительной реакции вычисляется по довольно сложной формуле, выражается в вольтах и может иметь как положительное, так и отрицательное значение в диапазоне от –3,0 до +2,50 В. ОВП зависит от большого количества внешних и внутренних фактров, но в определенных (стандартных) условиях однозначно характеризует свойства окислителяили восстановителя такой ОВП называется стандартным ред-окс потенциалом.
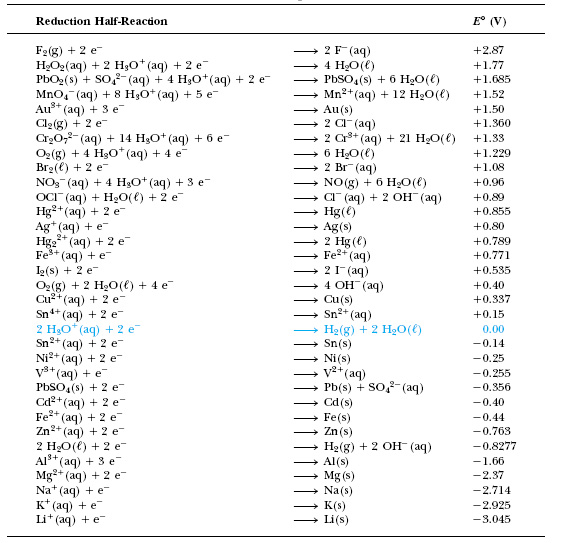
Стандартные окислительно-восстановительные потенциалы
Первое слагаемое в правой части уравнения Нернста
φ(Ox/Red) = φo(Ox/Red) + RT/(nF) ln [Ox]/[Red],
– это стандартный окислительно-восстановительный потенциал, т.е. потенциал, измеренный или чаще вычисленный при стандартных условиях. В стандартных условиях концентрации всех частиц в растворе по определению равны 1 моль/л, и второе слагаемое в правой части уравнения обращается в нуль. В нестандартных условиях, когда хотя бы одна из концентраций не равна 1 моль/л, определяемый уравнением Нернста потенциал отличается от стандартного. Потенциал в нестандартных условиях часто называют реальным потенциалом. Термином «электрохимический потенциал», строго говоря, пользоваться не рекомендуется, так как он закреплен за другой величиной (суммой химического потенциала иона и произведением его заряда на электрический потенциал), с которой студенты встретятся в курсе физической химии.
Если в ОВР принимают участие один или несколько газов, их стандартными состояниями являются состояния при давлении 1 атм = 101300 Па. Температура при определении стандартных состояний и стандартных потенциалов не стандартизуется и может быть любой, но таблицы стандартных потенциалов в справочниках составлены для Т=298 К (25 оС).
Необходимо отличать стандартные состояния веществ от не имеющих с ними по существу ничего общего нормальных условий (р = 1 атм, Т=273 К), к которым, пользуясь уравнением состояния идеальных газов pV = nRT, принято приводить объемы газов, измеренные в иных условиях.
Таблица стандартных потенциалов, составленная в порядке их убывания, однозначно ранжирует окислители (т.е. окисленные формы различных окислительно-восстановительных пар) по их силе. Одновременно ранжируются по силе и восстановители (восстановленные формы пар).
В природной воде значение потенциала колеблется от – 0,40 до + 0,70 В, что определяется всей совокупностью происходящих в ней окислительных и восстановительных процессов. В условиях равновесия значение ОВП определенным образом характеризует водную среду, и его величина позволяет делать некоторые общие выводы о химическом составе воды. В зависимости от значения ОВП различают несколько основных ситуаций, встречающихся в природных водах:
Окислительная: Характеризуется значениями Еh > + (100 - 150) мВ, присутствием в воде свободного кислорода, а также целого ряда элементов в высшей форме своей валентности (Fe3+, Mo6+, As5-, V5+, U6+, Sr4+, Cu2+, Pb2+). Ситуация, наиболее часто встречающаяся в поверхностных водах.
Переходная окислительно-восстановительная:
Определяется величинами Еh от 0 до + 100 мВ, неустойчивым геохимическим режимом и переменным содержанием сероводорода и кислорода. В этих условиях протекает как слабое окисление, так и слабое восстановление целого ряда металлов.
Восстановительная:
Характеризуется значениями Еh < 0. Типична для подземных вод, где присутствуют металлы низких степеней валентности (Fe2+, Mn2+, Mo4+, V4+, U4+), а также сероводород.
Окислительно-восстановительный потенциал зависит от температуры и взаимосвязан с рН. В некоторых применениях (например, в обработке воды для бассейнов) ОВП является одним из основных параметров контроля качества воды. В частности потому, что позволяет оценить эффективность обеззараживания воды.
Окислительно-восстановительный потенциал зависит от температуры и взаимосвязан с рН. В некоторых применениях (например, в обработке воды для бассейнов) ОВП является одним из основных параметров контроля качества воды. В частности потому, что позволяет оценить эффективность обеззараживания воды. В частности, при обслуживании бассейнов, используется таблица зависимости продолжительности жизни типичных микроорганизмов (E-Coli) от величины редокс-потенциала.
