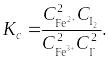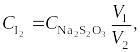- •Коллоквиум I химичесКая термодинамиКа
- •Коллоквиум I химическая термодинамика теоретическая часть
- •1.1. Химическая термодинамика
- •1.2. Термохимия
- •1.3. Калориметрические измерения
- •1.4. Определение теплоемкости калориметрической системы
- •1.5. Проведение калориметрического опыта и определение изменения температуры
- •1.6. Использование термохимических расчетов для энергетической характеристики биохимических процессов
- •1.7. Второй закон термодинамики
- •1.8. Термодинамические потенциалы
- •1.9. Организм как открытая система. Стационарное состояние организма
- •1.10. Химическое равновесие
- •Работа № 2 изучение равновесия гомогенной реакции в растворе
- •Объемы растворов, взятых для опыта
- •Данные, необходимые для расчета константы равновесия
- •Индивидуальные задания
- •Варианты индивидуальных заданий
Работа № 2 изучение равновесия гомогенной реакции в растворе
Цель работы: ознакомиться с основными свойствами обратимой реакции на примере реакции сульфата железа с иодидом калия; методом титрования проб определить равновесные концентрации реагентов и рассчитать константу равновесия; сделать вывод о влиянии концентрации реагентов на значение константы равновесия.
Растворы сульфата железа (III) и иодида калия смешивают в определенных соотношениях. Через определенные промежутки времени отбирают пробы и оттитровывают их раствором тиосульфата натрия в присутствии крахмала. Для момента установления равновесия рассчитывают равновесные концентрации участников реакции, определяют константы равновесия и делают соответствующие выводы.
Аппаpатуpа и реактивы: 4 конические колбы на 250 мл с притертыми пробками; 4 колбы Эрленмейера на 250 мл; бюретка для титрования; цилиндр; пипетка на 15 мл; водные растворы 0,04 М Fe2(SO4)3; 0,04 М KI; 0,02 M Na2S2O3; дистиллированная вода; раствор крахмала.
Реакция сульфата железа (III) с иодидом калия является обратимой, с течением времени устанавливается химическое равновесие
|
|
|
В сокращенной ионной форме его можно записать следующим образом:
|
|
|
Константу равновесия (Kс) можно рассчитать, если известны равновесные концентрации участников реакции:
|
|
(1.59) |
Методика проведения эксперимента. Для выполнения работы в четыре сухие пронумерованные колбы с притертыми пробками цилиндром отмеряют определенные количества растворов точной концентрации, указанных в табл. 1.3.
Таблица 1.3
Объемы растворов, взятых для опыта
Раствор, мл |
Номер колбы |
|||
|
1 |
2 |
3 |
4 |
0,04 М Fe2(SO4)3 |
50 |
|
55 |
|
0,04 М KI |
|
50 |
|
45 |
Сливают вместе содержимое 1-й и 2-й колб и через 10 мин содержимое 3-й и 4-й. Момент сливания растворов отмечают по часам, колбы закрывают пробками. Равновесие изучают при комнатной температуре или при той, что указана преподавателем. В последнем случае реакционные колбы до опыта и при его проведении находятся в термостате при заданной температуре. Через 25 мин после смешения из каждой колбы пипеткой отбирают 15 мл раствора и выливают в колбу для титрования, в которую предварительно наливают 50 мл охлажденной дистиллированной воды. За время отбора пробы считают момент сливания раствора из пипетки (с точностью до 1 мин). Выделившийся в результате реакции йод титруют 0,02 М раствором тиосульфата натрия до бледно-желтой окраски. Затем добавляют несколько капель раствора крахмала и оттитровывают далее тиосульфатом натрия до исчезновения синего окрашивания (появляющаяся через некоторое время синяя окраска раствора не учитывается).
Затем из каждой колбы с интервалом в 30 мин отбирают пробы по 15 мл, добавляют воду и титруют раствором тиосульфата натрия. Пробы отбирают до тех пор, пока в двух последовательно взятых пробах на титрование затрачивается одинаковый объем раствора тиосульфата натрия (расхождение не должно превышать 0,1 0,2 мл). Hа основании этих данных делают заключение о том, в течение какого времени устанавливается равновесие. Полученные данные заносят в табл. 1.4 и проводят расчет исходных и равновесных концентраций реагентов.
Оформление результатов. Исходную концентрацию раствора сульфата железа и иодида калия вычисляют с учетом степени разбавления раствора в процессе смешивания по формулам
|
|
(1.60) |
|
|
(1.61) |
где
![]()
начальные концентрации Fe2(SO4)3
и KI, моль/л; а
и b
объем растворов Fe2(SO4)3
и KI, взятых для проведения реакции, мл.
начальные концентрации Fe2(SO4)3
и KI, моль/л; а
и b
объем растворов Fe2(SO4)3
и KI, взятых для проведения реакции, мл.
Концентрацию йода в состоянии равновесия рассчитывают на основании результатов титрования:
|
|
(1.62) |
где
![]()
молярная концентрация раствора
тиосульфата натрия, моль/л; V1
объем тиосульфата, израсходованный на
титрование йода в момент установления
равновесия, мл; V2
объем пробы, взятой на титрование, мл.
молярная концентрация раствора
тиосульфата натрия, моль/л; V1
объем тиосульфата, израсходованный на
титрование йода в момент установления
равновесия, мл; V2
объем пробы, взятой на титрование, мл.
Концентрация ионов двухвалентного железа (согласно уравнению реакции) будет в два раза превышать концентрацию йода:
|
|
(1.63) |
Концентрацию ионов трехвалентного железа при равновесии определяют как разность между исходной концентрацией сульфата железа (III) и равновесной концентрацией ионов двухвалентного железа, так как прирост концентрации Fe2+ равен убыли концентрации Fe3+:
|
|
(1.64) |
Концентpацию ионов йода вычисляют по уравнению
|
|
(1.65) |
На основании полученных значений равновесных концентраций участников реакции для каждой колбы рассчитывают константу равновесия по формуле (1.59), определяют среднее значение. Если изучают реакцию при двух температурах, то на основании значений константы равновесия при этих температурах рассчитывают средний тепловой эффект реакции (изменение энтальпии реакции ) по уравнению (1.53).
Таблица 1.4