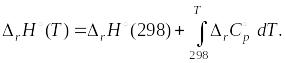- •Коллоквиум I химичесКая термодинамиКа
- •Коллоквиум I химическая термодинамика теоретическая часть
- •1.1. Химическая термодинамика
- •1.2. Термохимия
- •1.3. Калориметрические измерения
- •1.4. Определение теплоемкости калориметрической системы
- •1.5. Проведение калориметрического опыта и определение изменения температуры
- •1.6. Использование термохимических расчетов для энергетической характеристики биохимических процессов
- •1.7. Второй закон термодинамики
- •1.8. Термодинамические потенциалы
- •1.9. Организм как открытая система. Стационарное состояние организма
- •1.10. Химическое равновесие
- •Работа № 2 изучение равновесия гомогенной реакции в растворе
- •Объемы растворов, взятых для опыта
- •Данные, необходимые для расчета константы равновесия
- •Индивидуальные задания
- •Варианты индивидуальных заданий
1.2. Термохимия
Раздел физической химии, занимающийся изучением тепловых эффектов химических реакций, называется термохимией. Термохимия позволяет экспериментально определять тепловые эффекты процессов (используя калориметрический метод исследования). Это могут быть не только химические реакции, но и физико-химические процессы, например, растворение, кристаллизация, сублимация и др. Кроме того, из закона Гесса вытекают важные следствия, которые позволяют теоретически рассчитать изменение энтальпии химических реакций.
Расчет тепловых
эффектов химических реакций при
постоянном давлении и температуре, или
изменения энтальпии реакции (![]() )
(индекс “r”
обозначает “reaction”)
можно провести используя справочные
термодинамические данные о стандартных
энтальпиях образования или энтальпиях
сгорания веществ.
)
(индекс “r”
обозначает “reaction”)
можно провести используя справочные
термодинамические данные о стандартных
энтальпиях образования или энтальпиях
сгорания веществ.
Стандартной
энтальпией (теплотой) образования
вещества (![]() )
(индекс “f“
обозначает “formation”) называется изменение
энтальпии реакции образования одного
моль вещества из простых веществ, взятых
в устойчивом агрегатном состоянии при
давлении 101325 Па и температуре 298 К.
Так стандартная энтальпия образования
воды в жидком агрегатном состоянии
равна изменению энтальпии реакции
)
(индекс “f“
обозначает “formation”) называется изменение
энтальпии реакции образования одного
моль вещества из простых веществ, взятых
в устойчивом агрегатном состоянии при
давлении 101325 Па и температуре 298 К.
Так стандартная энтальпия образования
воды в жидком агрегатном состоянии
равна изменению энтальпии реакции
|
|
|
|
|
|
При этом энтальпия образования простых веществ (N2, O2, H2 и др.) принимается равной нулю.
Многие органические вещества нельзя синтезировать из простых веществ и одновременно определить стандартную энтальпию образования. Для органических соединений более легко определяемой экспериментально является энтальпия сгорания.
Стандартной
энтальпией (теплотой) сгорания вещества
(![]() )
(индекс “с”
обозначает “combustion”)
называют энтальпию реакции полного
окисления одного моль вещества c
образованием высших оксидов.
)
(индекс “с”
обозначает “combustion”)
называют энтальпию реакции полного
окисления одного моль вещества c
образованием высших оксидов.
Конечными продуктами сгорания для органических веществ соответствующего элементарного состава принято считать СО2(г), Н2О(ж), N2(г), С12(г), SO2(г) и т. д. Энтальпии сгорания СО2(г) и Н2О(ж) принимаются равными нулю. При этом необходимо иметь в виду, что теплоты образования СО2(г), Н2О(ж), SO2(г) тождественны теплотам сгорания простых веществ С(графит), Н2(г), S(ромб).
|
|
|
|
|
|
Используя сравнительно небольшое число справочных данных можно вычислить тепловые эффекты многих химических реакций.
Следствие 1. Стандартная энтальпия химической реакции равна разности сумм стандартных энтальпий образования продуктов реакции и исходных веществ (с учетом стехиометрических коэффициентов):
|
|
(1.19) |
Следствие 2. Стандартная энтальпия химической реакции равна разности сумм стандартных энтальпий сгорания исходных веществ и продуктов реакции (с учетом стехиометрических коэффициентов):
|
|
(1.20) |
Это следствие чаще используется для расчета тепловых эффектов реакций с участием органических соединений.
Термохимия вводит понятие “термохимическое уравнение”. Это уравнение химической реакции, в котором, наряду с формулами исходных веществ и продуктов реакции, указаны стехиометрические коэффициенты, агрегатное состояние веществ и изменение энтальпии реакции, отнесенное к одному моль вещества. Например:
|
|
|
или
|
|
|
Так как изменение
энтальпии реакции относится к
энергетическим изменениям в системе,
то отрицательное значение ее (![]() )
соответствует экзотермическому процессу,
а положительное (
)
соответствует экзотермическому процессу,
а положительное (![]() )
– эндотермическому.
)
– эндотермическому.
Преобладающее большинство термохимических данных в справочниках приведено при температуре 298 К. Однако, тепловой эффект химической реакции зависит от температуры. Данная зависимость в изобарных и изохорных условиях определяется уравнением Кирхгофа, дифференциальная форма которого имеет вид
|
|
(1.21) |
|
|
(1.22) |
где
![]() и
и
![]() –
разность сумм молярных теплоемкостей
(
–
разность сумм молярных теплоемкостей
(![]() ,)
продуктов реакции и исходных веществ,
взятых с учетом стехиометрических
коэффициентов.
,)
продуктов реакции и исходных веществ,
взятых с учетом стехиометрических
коэффициентов.
|
|
(1.23) |
Для расчета тепловых эффектов при температурах отличных от 298 К, удобно использовать уравнение Кирхгофа в интегральной форме:
|
|
(1.24) |
При решении данного уравнения можно рассмотреть два случая.
1. Если разность
температур T
– 298 невелика,
то можно принять
![]() и
уравнение примет вид
и
уравнение примет вид
|
|
(1.25) |
2. При большой разности
температур T
– 298 необходимо
учитывать температурную зависимость
теплоемкости веществ от температуры
![]() .
.
Зависимость теплоемкости веществ от температуры является обычно сложной и в общем виде выражается уравнениями вида
|
|
(1.26) |
|
|
(1.27) |
Тогда на основании уравнения (1.26) общее изменение теплоемкости в результате протекания процесса рассчитывают по формуле
|
|
(1.28) |
В отличие от
теплоемкостей участников реакции,
которые являются только положительными
величинами, разность
![]() может
быть как положительной, так и отрицательной.
При этом изменение
может
быть как положительной, так и отрицательной.
При этом изменение
![]() с
температурой определяется видом
зависимости
с
температурой определяется видом
зависимости
![]() .
Из (1.21) и (1.22) следует, что:
.
Из (1.21) и (1.22) следует, что:
1) если теплоемкость
продуктов реакции больше теплоемкости
исходных веществ, т. е. изменение
теплоемкости для данной реакции
положительно (![]() ),
то повышение температуры делает величину
более
положительной, т. е. более эндотермической;
),
то повышение температуры делает величину
более
положительной, т. е. более эндотермической;
2) если теплоемкость
продуктов реакции меньше теплоемкости
исходных веществ (![]() ),
то повышение температуры оказывает
противоположное действие, т. е. делает
реакцию более экзотермической;
),
то повышение температуры оказывает
противоположное действие, т. е. делает
реакцию более экзотермической;
3) если теплоемкости
начальных и конечных веществ одинаковы
(![]() ),
то изменение температуры не влияет на
величину изменения энтальпии реакции.
),
то изменение температуры не влияет на
величину изменения энтальпии реакции.
Таким образом, с помощью уравнения Кирхгофа в интегральной форме можно вычислить изменение энтальпии при любой температуре, если известны значение энтальпии реакции при температуре 298 К и зависимость теплоемкостей начальных и конечных веществ от температуры в заданном интервале ее значений.