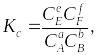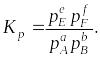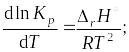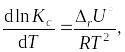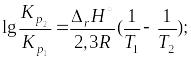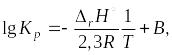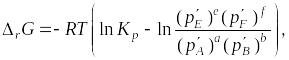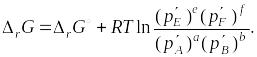- •Коллоквиум I химичесКая термодинамиКа
- •Коллоквиум I химическая термодинамика теоретическая часть
- •1.1. Химическая термодинамика
- •1.2. Термохимия
- •1.3. Калориметрические измерения
- •1.4. Определение теплоемкости калориметрической системы
- •1.5. Проведение калориметрического опыта и определение изменения температуры
- •1.6. Использование термохимических расчетов для энергетической характеристики биохимических процессов
- •1.7. Второй закон термодинамики
- •1.8. Термодинамические потенциалы
- •1.9. Организм как открытая система. Стационарное состояние организма
- •1.10. Химическое равновесие
- •Работа № 2 изучение равновесия гомогенной реакции в растворе
- •Объемы растворов, взятых для опыта
- •Данные, необходимые для расчета константы равновесия
- •Индивидуальные задания
- •Варианты индивидуальных заданий
1.9. Организм как открытая система. Стационарное состояние организма
Классическая термодинамика чаще рассматривает изолированные системы, предполагая, что они в определенный момент достигнут состояния равновесия и будут находиться в нем неопределенно долгое время. Живые организмы относятся к открытым системам, которые обмениваются с окружающей средой энергией и веществом. Поэтому для рассмотрения открытых систем используются методы термодинамики необратимых процессов, то есть неравновесной термодинамики.
Неравновесные процессы возникают при наличии в разных частях системы конечных разностей таких параметров как температура, давление и др. Однако такое неравновесное распределение параметров по всему объему системы остается постоянным во времени. При этом в каждой точке градиенты параметров постоянны (градиент – это изменение какой-либо величины на единицу длины в определенном направлении). Такие процессы называются стационарными, поэтому состояние живого организма называется также стационарным.
Оно внешне похоже на равновесное тем, что концентрации частиц поддерживаются постоянными. Однако, для поддержания стационарного (неравновесного) состояния приходится постоянно обеспечивать приток и отток вещества из системы.
При применении законов термодинамики к живым организмам необходимо учитывать их взаимодействие с окружающей средой.
Так, например, изменение энтропии в биологических системах складывается из двух слагаемых:
1) изменение энтропии, обусловленное протеканием биохимических процессов внутри системы;
2) изменение энтропии, обусловленное взаимодействием с окружающей средой.
В результате протекания биохимических процессов в организме энергия системы уменьшается, а энтропия увеличивается. Однако, наряду с приростом энтропии происходит ее уменьшение в результате потребления организмом из окружающей среды питательных веществ с низкими значениями энтропии (это высокомолекулярные соединения – белки, углеводы, жиры) и выделением в окружающую среду продуктов метаболизма, обладающих значительно большими значениями энтропии. Но во всех случаях энтропия системы “организм-среда” возрастает, что находится в полном соответствии со вторым законом термодинамики.
1.10. Химическое равновесие
Известно, что многие химические реакции не доходят до конца, т. е. исходные вещества не расходуются полностью на образование продуктов реакции. В этом случае система находится в состоянии динамического равновесия, с течением времени при определенных условиях скорость прямой реакции становится равной скорости обратной реакции. При неизменности внешних условий состояние равновесия продолжается сколь угодно долго, при этом с термодинамической точки зрения соотношение концентраций исходных веществ и продуктов реакции поддерживается постоянным и отвечает минимальному значению свободной энергии Гиббса. Постоянство состава системы может служить признаком, достаточным для констатирования наступления равновесия, лишь для реакций, протекающих сравнительно быстро. Для реакций, протекающих с незначительной скоростью, состав смеси может оставаться постоянным продолжительное время и состояние равновесия оказывается кажущимся. Для установления равновесия необходимо воспользоваться вторым признаком равновесия признаком его подвижности. Если система, находящаяся в состоянии равновесия, будет выведена из этого состояния под действием внешних факторов (температура, давление), то после прекращения таких воздействий она самопроизвольно должна вернуться в прежнее состояние. Если же этого не происходит, то система еще не достигла состояния равновесия. Поэтому состояние химического равновесия характеризуется двумя признаками: постоянством состава при данных внешних условиях и подвижностью. Состав равновесной смеси определяется константой равновесия, при этом концентрации исходных веществ и продуктов реакции находятся в некотором соотношении.
Для реакции аА + вВ = еЕ + fF при равновесии скорость прямой реакции равна скорости обратной реакции и константа равновесия (Kс) может быть представлена соотношением:
|
|
(1.49) |
где С равновесные мольные концентрации веществ А, В, Е, F; а, b, e, f стехиометрические коэффициенты.
Константу равновесия можно выразить через равновесные парциальные давления компонентов системы:
|
|
(1.50) |
Связь между Kр и Kс описывается уравнением
|
|
|
где ν = (e + f) (a + b).
Учение о химическом равновесии позволяет рассчитывать выход продуктов реакции и раскрывает возможности управления химическими процессами. Следует помнить, что равновесие системы может смещаться при изменении концентрации реагирующих веществ, давления и температуры, константа же равновесия зависит только от температуры. Данная зависимость описывается уравнением изобары (1.51) или изохоры (1.52) Вант-Гоффа:
|
|
(1.51) |
|
|
(1.52) |
где
изменение энтальпии,
![]()
изменение внутренней энергии реакции.
изменение внутренней энергии реакции.
Для химических
реакций
и
являются
тепловыми эффектами реакций соответственно
при р
= const и V
= const. Знак теплового эффекта определяет
зависимость константы равновесия от
температуры. Если
![]() ,
то реакция эндотермическая, знак
производной
,
то реакция эндотермическая, знак
производной
![]() будет
положительный, следовательно, с
увеличением температуры константа
равновесия эндотермической реакции
возрастает. При этом равновесие может
смещаться в сторону образования продуктов
реакции.
будет
положительный, следовательно, с
увеличением температуры константа
равновесия эндотермической реакции
возрастает. При этом равновесие может
смещаться в сторону образования продуктов
реакции.
Если принять, что энтальпия химической реакции постоянна в интервале температур от T1 до T2, то уравнение Вант-Гоффа можно представить в интегральной форме:
|
|
(1.53) |
|
|
(1.54) |
где В постоянная интегрирования.
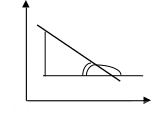
На основании уравнения (1.54), зная константы равновесия при четырех пяти значениях температуры, можно определить тепловой эффект реакции графическим методом (рис. 1.3):
|
где
|
Рис. 1.3. Зависимость lg Kp от обратной температуры
Для определения направления протекания химической реакции при заданных значениях температуры и давления используют уравнение изотермы химической реакции
|
|
(1.55) |
где
![]()
изменение изобарно-изотермического
потенциала реакции,
изменение изобарно-изотермического
потенциала реакции,
![]() ,
исходные парциальные давления участников
реакции,
,
исходные парциальные давления участников
реакции,
![]()
константа равновесия, выраженная через
равновесные парциальные давления
компонентов.
константа равновесия, выраженная через
равновесные парциальные давления
компонентов.
Если
реакции
< 0, то при данной температуре и заданных
исходных парциальных давлениях участников
реакции процесс будет протекать
самопроизвольно.
Если
![]() ,
то реакция при этих условиях достигает
состояния равновесия.
При стандартных условиях, когда исходные
парциальные давления равны 1,01325·105
Па (1атм) (
,
то реакция при этих условиях достигает
состояния равновесия.
При стандартных условиях, когда исходные
парциальные давления равны 1,01325·105
Па (1атм) (![]() =
1,01325∙105
Па (1атм)), уравнение изотермы имеет вид
=
1,01325∙105
Па (1атм)), уравнение изотермы имеет вид
|
|
(1.56) |
Тогда в общем виде можно записать
|
|
(1.57) |
Из уравнения (1.57)
видно, что если при стандартных условиях
![]() ,
то это не свидетельствует о том, что
реакция не пойдет. Можно подобрать такое
соотношение исходных парциальных
давлений и концентраций, при которых
станет
меньше нуля и реакция будет протекать
самопроизвольно.
,
то это не свидетельствует о том, что
реакция не пойдет. Можно подобрать такое
соотношение исходных парциальных
давлений и концентраций, при которых
станет
меньше нуля и реакция будет протекать
самопроизвольно.