
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •7 Вопрос
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •11 Вопрос
- •12 Вопрос
- •13 Вопрос
- •14 Вопрос
- •15 Вопрос
- •16 Вопрос
- •17 Вопрос
- •18 Вопрос
- •19 Вопрос
- •20 Вопрос
- •21 Вопрос
- •22 Вопрос
- •23 Вопрос
- •24 Вопрос
- •25 Вопрос
- •26 Вопрос
- •27 Вопрос
- •28 Вопрос
- •29 Вопрос
- •30 Вопрос
- •31 Вопрос
- •32 Вопрос
- •33 Вопрос
- •34 Вопрос
- •35 Вопрос
- •36 Вопрос
- •37 Вопрос
- •38 Вопрос
- •39 Вопрос
- •40 Вопрос
- •41 Вопрос
- •42 Вопрос
- •43 Вопрос
- •44 Вопрос
43 Вопрос
Внутренняя энергия реального газа. Эффект Джоуля-Томсона.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ.
р΄=а/V2
Работа, которая затрачивается для преодоления сил притяжения, действующих между молекулами газа, или, иными словами, против внутреннего давления, как известно из механики, идёт на увеличение потенциальной энергии системы.
Т.е. dA=p΄Vm=dП, или dП=a/V2m*dVm, откуда П=-а/Vm.
Знак минус означает, что молекулярные силы, создающие внутреннее давление р΄, являются силами притяжения. Учитывая оба слагаемых, получим, что внутренняя энергия моля реального газа Um=CVT-a/Vm растёт с повышением температуры и увеличением объёма.
Если газ расширяется без теплообмена с окружающей средой и не совершает внешней работы, то на основании первого начала термодинамики получим, что U1=U2. Следовательно, при адиабатическом расширении без совершения внешней работы внутренняя энергия газа не изменяется.
Эффе́ктом Джо́уля — То́мсона называется изменение температуры газа при адиабатическом дросселировании — медленном протекании газа под действием постоянного перепада давлений сквозь дроссель (пористую перегородку). Данный эффект является одним из методов получения низких температур.
Изменение энергии
Изменение энергии газа в ходе этого процесса будет равно работе:
![]()
Следовательно, из определения энтальпии
![]()
следует, что процесс изоэнтальпиен.
Изменение температуры
Изменение температуры при малом изменении давления (дифференциальный эффект) в результате процесса Джоуля — Томсона определяется производной
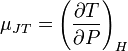
называемой коэффициентом Джоуля — Томсона. С помощью элементарных преобразований можно получить выражение для этого коэффициента:
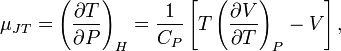
Где
![]() теплоёмкость при постоянном давлении.
Для идеального газа
теплоёмкость при постоянном давлении.
Для идеального газа
![]() а для реального газа он определяется
уравнением состояния.
а для реального газа он определяется
уравнением состояния.
Если при протекании газа через пористую
перегородку температура возрастает
(![]() )
то эффект называют отрицательным, и
наоборот, если температура убывает
)
то эффект называют отрицательным, и
наоборот, если температура убывает
(![]() )
то процесс называют положительным.
Температуру, при которой меняет знак,
называют температурой инверсии.
)
то процесс называют положительным.
Температуру, при которой меняет знак,
называют температурой инверсии.
Применение
Процесс Джоуля — Томсона используют для получения низких температур. Для этой цели обычно применяют интегральный процесс, при котором давление изменяется в широких пределах.
Измерение позволяет установить уравнение состояния газа.
44 Вопрос
Особенности жидкого и твердого состояния вещества.
Жидкости занимают промежуточное положение между газообразными и твердыми веществами. При температурах, близких к температурам кипения, свойства жидкостей приближаются к свойствам газов; при температурах, близких к температурам плавления, свойства жидкостей приближаются к свойствам твердых веществ. Если для твердых веществ характерна строгая упорядоченность частиц, распространяющаяся на расстояния до сотен тысяч межатомных или межмолекулярных радиусов, то в жидком веществе обычно бывает не более нескольких десятков упорядоченных частиц - объясняется это тем, что упорядоченность между частицами в разных местах жидкого вещества так же быстро возникает, как и вновь «размывается» тепловым колебанием частиц. Вместе с тем общая плотность упаковки частиц жидкого вещества мало отличается от твердого вещества - поэтому их плотность близка к плотности твердых тел, а сжимаемость очень мала. Например, чтобы уменьшить объем, занимаемый жидкой водой, на 1%, требуется приложить давление ~ в 200 атм, тогда как для такого же уменьшения объема газов требуется давление порядка 0,01 атм. Следовательно, сжимаемость жидкостей примерно и 200 : 0,01 = 20000 раз меньше сжимаемости газов.
Выше отмечалось, что жидкости имеют определенный собственный объем и принимают форму сосуда, в котором находятся; эти их свойства значительно ближе к свойствам твердого, чем газообразного вещества. Большая близость жидкого состояния к твердому подтверждается также данными по стандартным энтальпиям испарения ∆Н°исп и стандартным энтальпиям плавления ∆Н°пл. Стандартной энтальпией испарения называют количество теплоты, необходимое для превращения 1 моль жидкости в пар при 1 атм (101,3 кПа). То же количество теплоты выделяется при конденсации 1 моль пара в жидкость при 1 атм. Количество теплоты, расходуемое на превращение 1 моль твердого тела в жидкость при 1 атм, называют стандартной энтальпией плавления (то же количество теплоты высвобождается при «замерзании» («отвердевании») 1 моль жидкости при 1 атм). Известно, что ∆Н°пл намного меньше соответствующих значений ∆Н°исп, что легко понять, поскольку переход из твердого состояния в жидкое сопровождается меньшим нарушением межмолекулярного притяжения, чем переход из жидкого в газообразное состояние.
Ряд других важных свойств жидкостей больше напоминает свойства газов. Так, подобно газам жидкости могут течь - это их свойство называется текучестью. Сопротивляемость течению определяется вязкостью. На текучесть и вязкость влияют силы притяжения между молекулами жидкости, их относительная молекулярная масса, а также целый ряд других факторов. Вязкость жидкостей ~ в 100 раз больше, чем у газов. Так же, как и газы, жидкости способны диффундировать, хотя и гораздо медленнее, поскольку частицы жидкости упакованы гораздо плотнее, чем частицы газа.
Одно из важнейших свойств именно жидкости - ее поверхностное натяжение (это свойство не присуще ни газам, ни твердым веществам). На молекулу, находящуюся в жидкости, со всех сторон равномерно действуют межмолекулярные силы. Однако на поверхности жидкости баланс этих сил нарушается, и вследствие этого «поверхностные» молекулы оказываются под действием некой результирующей силы, направленной внутрь жидкости. По этой причине поверхность жидкости оказывается в состоянии натяжения. Поверхностное натяжение - это минимальная сила, сдерживающая движение частиц жидкости в глубину жидкости и тем самым удерживающая поверхность жидкости от сокращения. Именно поверхностным натяжением объясняется «каплевидная» форма свободно падающих частиц жидкости.
Различают два состояния твердых веществ - кристаллическое и аморфное. Кристаллическое состояние характеризуется упорядоченной структурой. Упорядоченность в кристаллах обусловливается правильным геометрическим расположением частиц, из которых состоит твердое вещество. Каждое кристаллическое вещество имеет определенную, характерную форму. Например, кристаллы поваренной соли имеют форму куба, калийной селитры - форму призмы, алюминиевых квасцов - форму октаэдров и т. д.
Аморфные вещества не образуют правильной геометрической структуры, представляя собой структуры неупорядоченно расположенных молекул. В отличие от кристаллических веществ, имеющих вполне определенную температуру плавления, аморфные вещества плавятся в широком интервале температур. При нагревании они постепенно размягчаются, затем начинают растекаться и, наконец, становятся жидкими.
Примерами аморфных веществ могут быть стекла и смолы. К аморфным веществам относится также большинство полимеров. Некоторые вещества могут находиться и в кристаллическом, и в аморфном состояниях, - например сера, оксид кремния ( IV ) и др.
Многие вещества могут быть переведены из аморфного состояния в кристаллическое и наоборот. Так, аморфное стекло после выдержки при определенной температуре «расстекловывается», т.е. в нем появляются мелкие кристаллики и стекло мутнеет. Аморфные вещества особенно сильно отличаются от кристаллических по своим физическим свойствам.
Стоит также отметить, что если свойства аморфных веществ изотропны (одинаковы по всем направлениям), то свойства кристаллов анизотропны, что особенно наглядно проявляется при исследовании таких веществ оптическими методами. Подавляющее большинство твердых веществ имеет кристаллическое строение.
