
- •Типы крист. Решеток:
- •1) Типы химической связи
- •2) Ионное произведение воды
- •1)Метод валентных связей
- •2) Общие свойства растворов. Активность.
- •1) Вандерваальсовы силы.
- •2)Сольватная теория растворения
- •1) Химическая связь в комплексных соединениях.
- •2) Свойства коллоидно-дисперсных систем
- •1) Общие понятия термодинамики
- •2) Понятие о химическом сродстве веществ. Уравнения изотермы, изобары и изохоры химических реакций
- •1) Энергия Гиббса, энергия Гельмгольца и направленность химических реакций
- •2) Фаз Гиббса. Диаграмма состояния воды
Билет 1 1) Атомный вес элемента равен среднему значению из атомных весов всех его природных изотопов с учетом их распространенности. Деффект массы - уменьшение массы атома по сравнению с суммарной массой всех отдельно взятых составляющих его элементарных частиц, обусловленное энергией их связи в атоме.
2)Коррозия – это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. Это процесс самопроизвольный, идущий с уменьшением энергии Гиббса системы и выделением теплоты в окружающую среду. Защиту металлов от коррозии проводят следующими методами: легирование металлов , электрохимическая защита, изменение свойств коррозионной среды, рациональное конструирование изделий.
Билет 2
1) Закон постоянства состава, закон кратных отношений и закон эквивалентов.
Закон постоянства состава: химические соединения с молекулярной структурой имеют один и тот же состав и свойства независимо от способа получения. Закон кратных отношений: если два элемента образуют друг с другом несколько соединений с молекулярной структурой, то на одно и то же массовое количество одного из них приходятся такие количества другого, которые относятся между собой как целые числа. Закон эквивалентов: отношения масс, вступающих в химическую реакцию веществ, равны или кратны их эквивалентам, т.е., все вещества реагируют в эквивалентных отношениях.
2) Металлическая связь проявляется при взаимодействии атомов элементов, имеющих избыток свободных валентных орбиталей по отношению к числу валентных орбиталей электронов. Способы получения металлов: Восстановление из их оксидов углем или оксидом углерода, водородом, алюминотермия, обжиг сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем), электролиз расплавов солей
Билет 3
1)
Агрегатное состояние не
влияет на химические свойства и
химическое строение вещества, а влияет
на физическое состояние (плотность,
вязкость, температуру и т.д.) и скорость
химических процессов. Например, вода
в газообразном состоянии – пар, в жидком
– жидкость, в твердом – лед, снег, иней.
Химический состав один и тот же, а
физические свойства различны. Различие
физических свойств связано с разными
расстояниями между молекулами вещества
и силами притяжения между ними. Для
газов
характерны большие расстояния между
молекулами и малые силы притяжения.
Молекулы газов находятся в хаотичном
движении. Это объясняет то, что плотность
газов мала, они не имеют собственной
формы, занимают весь предоставленный
им объем, при изменении давления газы
изменяют свой объем. Идеальным
называется газ, находящийся в таких
условиях, при которых можно пренебречь
силами взаимодействия между молекулами
и собственным объемом молекул, который
чрезвычайно мал по сравнению с общим
объемом газа. Существующий в природе
газ называется реальным.
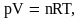
2) Электролизом называют процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника тока через электролиты.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональна количеству электричества Q, прошедшему через электролит:
m = kQ, но Q =I
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
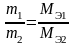
Билет 4
1) В жидком состоянии молекулы более сближены, силы межмолекулярного притяжения возрастают, молекулы находятся в хаотично-поступательном движении. Поэтому плотность жидкостей намного больше плотности газов, объем определенный, почти не зависит от давления, но жидкости не имеют собственной формы, а принимают форму предоставленного сосуда. Для них характерен «ближний порядок», то есть зачатки кристаллической структуры
2) Изменение потенциала электрода при прохождении тока называется поляризацией:
E = Ei – Ep Термин «поляризация» употребляют как для обозначения величины изменения потенциала, так и самого явления изменения потенциала при прохождении тока. Различают анодную и катодную поляризацию. Если известны причины изменения потенциала, например, катодное выделение водорода, то изменение потенциала называют перенапряжением.
Билет 5
1) В твердых телах частицы (молекулы, атомы, ионы) сближены настолько друг с другом, что силы притяжения уравновешиваются силами отталкивания. Поэтому частицы твердых тел располагаются в определенных точках пространства, для них характерен дальний порядок, твердые тела имеют определенную форму, объем.
Типы крист. Решеток:
Молекулярные кристаллы (вандерваальсовы и водородные силы : Аr, О2, N2, СО2, Н2О), Атомно-ковалентные кристаллы (ковалентные связи : C, Ge, Si, SiO2, SiC), Ионные кристаллы (ионные силы: KCl, CaF2, Na2CO3), Металлические кристаллы (К, Са, Zn, Ni).
2) Уравнение Нернста. Классификация электродов.
При
расчете потенциала используют уравнение
Нернста в общем виде
![]() Электроды первого рода – это металл,
погруженный в раствор своей хорошо
растворимой соли, он обратим относительно
катионов металла. При этом протекает
обратимая электрохимическая
Электроды первого рода – это металл,
погруженный в раствор своей хорошо
растворимой соли, он обратим относительно
катионов металла. При этом протекает
обратимая электрохимическая
Электроды второго рода – это металл, покрытый своей труднорастворимой солью и обратим относительно аниона. Такие электроды используют как электроды сравнения, поскольку они обладают малым температурным коэффициентом и равновесие в системе устанавливается достаточно быстро.
Билет 6
1) Современная модель атома:
В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома (например, радиус атома водорода сост. 0,046 нм, а радиус протона или ядра атома водорода составляет 6,5.10-7 нм). Положительный заряд и почти вся масса атома сосредоточены в ядре атома. Ядра атомов состоят из протонов и нейтронов (общее название нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов (p) и нейтронов (n) соответствует его массовому числу. Вокруг ядра по орбиталям вращаются электроны. Число электронов в невозбужденном (основном) сост. равно заряду ядра Различные виды атомов имеют общее название – нуклиды. Нуклиды с одинаковым зарядом, различными массовыми числами и числом нейтронов в ядре называется изотопами. Нуклиды с одинаковыми массовыми числами, но различными зарядами ядра и числа нейтронов в ядре называются изобарами. Нуклиды с одинаковым числом нейтронов, но различным зарядом и массовым числом называется изотонами.
2) Гальванический элемент Даниэля-Якоби: . Он состоит из двух полуэлементов: из цинковой пластины, погруженной в раствор ZnSO4 и медной пластины, погруженной в раствор CuSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой, (-)Zn/ZnSO4//CuSO4/Cu(+)
При погружении цинковой пластины в раствор ZnSO4 ионы цинка из кристаллической решетки пластины будут переходить в раствор, заряжая пластину отрицательно, за счет избытка электронов на пластине, т.е. происходит поверхностное растворение цинка. При погружении медной пластины в раствор CuSO4 ионы меди ионы раствора будут осаждаться на пластине, заряжая ее положительно, т. е. происходит осаждение меди. Если соединить внутренние и внешние цепи, то избыток электронов с цинковой пластины будут переходить по проводнику на медную пластину, компенсируя ее положительный заряд, а избыток сульфат ионов (SO42-) из раствора CuSO4 через пористую перегородку в раствор ZnSO4, компенсируя избыток ионов цинка.
Таким образом, при замыкании цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделение меди на медном электроде.
Билет 7
1) Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах
2) На границе металл – раствор возникает двойной электрический слой. Одна часть этого слоя находится на поверхности металла, а другая часть – в жидкости, которая омывает данный металл. Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом, С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной растет. При некотором значении электродного потенциала скорость прямого процесса будет равна скорости обратно процесса и устанавливает равновесие. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Билет 8
1)Квантовые числа: Главное квантовое число (n) определяет энергию и размеры электронных орбиталей, удаленность уровня от ядра. Принимает целые значения (n = 1, 2, 3... до беск.) и соответствует номеру периода. Число n показывает, сколько подуровней имеет каждый уровень, и какой энергетический уровень является внешним. Чем больше n, тем выше энергия.. Орбитальное квантовое число определяет форму атомной орбитали и характеризует энергетические подуровни. Величина L принимает целочисленные значения от 0 до (n – 1) и может обозначаться буквами. Магнитное квантовое число (mL) характеризует ориентацию орбиталей в пространстве относительно внешнего магнитного или электрического поля и их максимального количества для подуровней. В отсутствие внешнего магнитного поля все орбитали одного подуровня имеют одинаковое значение энергии. Величина mL принимает целочисленные значения от –L до +L, включая ноль, и меняется скачкообразно. Это означает, что для каждой формы орбитали существует (2L + 1), энергетически равноценных ориентации в пространстве. Спиновое квантовое число (mS) характеризует механический момент движения электронов и имеет два значения +1/2 и –1/2, соответствующие противоположным направлениям вращения. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками ↑ ↓.
2) Общие понятия элекрохимии
Электрохимия – это раздел химии, занимающийся изучением закономерностей взаимных превращений электрической и химической энергии. К проводникам первого рода относятся металлы, сплавы, уголь и графит. Электропроводность проводников первого рода обусловлена наличием в их кристаллической решетке свободных и слабосвязанных электронов, т. е. это электронная проводимость. Она не сопровождается переносом вещества и не влечет за собой химического превращения материала, из которого сделан проводник. К проводникам второго рода относятся расплавы и растворы электролитов. В данном случае перенос электричества осуществляется ионами электролита, т. е. это ионная проводимость. В результате этого наблюдается химическое превращение вещества. Происходит окислительно-восстановительная реакция, в которой процессы окисления и восстановления происходят на разных электродах (аноде и катоде).
Билет 9
1) Строение многоэлектронных атомов. Подобно любой системе, атомы стремятся к минимуму энергии. Это достигается при определенном состоянии электронов, т.e. при определенном распределении электронов по орбиталям. Запись распределения электронов в атоме по оболочкам, подоболочкам и орбиталям получила название электронной конфигурации элемента, которое можно оценить на основе следующих закономерностей. При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип минимальной энергии, принцип Паули, правила Гунда (Хунда) и Клечковского. Принцип минимальной энергии: электроны в невозбужденном атоме распределяются по орбиталям таким образом, чтобы суммарная энергия атома была минимальной. Правило В. Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + L, а при равной сумме n + L в порядке возрастания n. Принцип запрета Паули : на одной атомной орбитали (в одной квантовой ячейке) не может быть более двух электронов, причем они должны иметь противоположные (антипараллельные) спины. Правило Гунда (Хунда): при наличии нескольких пустых или наполовину заполненных ячеек данного подуровня электроны занимают максимально возможное число пустых ячеек.
2) Особенности окислительно-восстановительных процессов.
При окислительно-восстановительных реакциях происходит изменение степени окисления вещества. Реакции можно разделить на те, которые проходят в одном реакционном объеме (например, в растворах) и разных (электрохимические). Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление – это процесс отдачи электронов веществом, т. е. повышение его степени окисления, вещество при этом называют восстановителем. Восстановление – это процесс присоединения электронов к веществу, т. е. понижение его степени окисления и вещество при этом называется окислителем
Билет 10
1) . Периодические свойства элементов . Так как электронное строение элементов изменяется периодически, то, соответственно, периодически изменяются и свойства элементов, определяемые их электронным строением, такие как энергия ионизации, размеры атомов, окислительно-восстановительные и другие свойства. Энергией ионизации называется энергия, необходимая для удаления одного моля электронов от одного моля атомов какого-либо элемента. Сродство к электрону – это энергетический эффект присоединения моля электронов к молю нейтральных атомов. Электроотрицательность (ЭО) – это характеристика способности атомов в соединениях притягивать к себе электроны.
2) Теории кислот и оснований. Согласно теории электролитической диссоциации, применимой к водным растворам, кислотой является электролит, который диссоциирует с образованием ионов Н (или гидроксония Н3О+). Электролит, диссоциирующий с образованием ОН называют основанием. О силе кислот можно судить по константе диссоциации. Чем больше константа диссоциации, тем больше диссоциирована кислота. Протонная теория кислот и оснований Д. Брендстеда применима как к водным, так и неводным средам. Согласно протонной теории, кислоту считают донором протона, а основание – акцептором протонов. При взаимодействии кислота отдает, а основание принимает протон. Соотношение между основанием и кислотой можно представить схемой: Основание + Протон Кислота Электронная теория кислот и оснований выдвинута Дж. Льюисом. Согласно этой теории, кислота является акцептором, а основание – донором электронов. Если в состав кислоты входит водород, то она называется водородной, а если не входит, то – апротонной. Взаимодействие кислоты и основания по Льюису, приводит к образованию ковалентной связи по донорно-акцепторному механизму.
Билет 11
1) Периодический закон Менделеева: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов. Периодическая система элементов состоит из периодов, групп и подгрупп. Периодом называется последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от ns1 до ns2np6 (или до ns2 у первого периода)
2) Особенности обменных процессов
Они возможны при условии, что образуется осадок, малодиссоциирующее вещество или выделяется газ.
Типы обменных химических процессов в водной среде: реакции нейтрализации – процесс между кислотой и щелочью:
HCl + NaOH → NaCl + H2O,
взаимодействие между кислотой и солью:
HCl + AgNO3 → HNO3+ AgCl↓,
реакции между щелочью и солью:
Ba(OH)2 + K2SO4 → BaSO4↓ + KOH,
реакции между двумя растворимыми солями:
AgNO3 + KCl → KNO3 + AgCl↓,
гидролиз солей – реакции обмена между водой и растворенными в ней солями. Гидролизу подвергаются растворимые соли, образованные сильными кислотами и слабыми основаниями; слабыми кислотами и сильными основаниями; слабыми кислотами и слабыми основаниями. Константа гидролиза соли зависит от природы соли, температуры. Показателем глубины протекания гидролиза является степень гидролиза (β), которая представляет собой отношение концентрации гидролизованных молекул.
Билет 12
1) химическая связь – это совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулы, ионы и др. частицы. По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом. Единственным критерием химического взаимодействия атомов, ионов или молекул является изменение электронной плотности. Длиной химической связи называют величину, измеряемую расстоянием между ядрами связываемых атомов. Длина связи определяется рентгеноструктурным анализом и другими физическими методами.
Прочность химической связи – величина, измеряемая энтальпией ∆Нс образования связи. В качестве единицы измерения прочности химической связи используют кДж/моль. Ориентация химической связи – величина, измеряемая углом между направлениями связей данного атома с соседними атомами молекулы. Полярность химической связи – величина, измеряемая электрическим моментом данной связи. Химическая связь поляризуется, когда связываются два атома с разной ЭО.
2)Свойства сильных электролитов
Электролиты, практически полностью диссоциирующие в водных растворах, называются сильными электролитами. Многие свойства растворов, такие, как осмотическое давление, температура кипения и замерзания, давление насыщенного пара растворителя над раствором, зависят как от концентрации раствора, т. е. от числа растворенных в нем частиц, так и от взаимного влияния этих частиц друг на друга. Степень взаимодействия частиц в растворе тем выше, чем больше плотность их зарядов и чем меньше среднее расстояние между ними. Теория сильных электролитов, Дебая и Хюккеля: в растворах сильных электролитов действуют электростатические силы притяжения между разноименными ионами и силы отталкивания – между одноименными. Ионной силой раствора называется полусумма произведений концентраций всех ионов присутствующих в растворе, на квадрат их заряда. Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах. Коэффициенты активности ионов уменьшаются с увеличением ионной силы растворов и заряда ионов
Билет 13
