
- •7.Методы измерения статического давления и скорости жидкости
- •8.Течение жидкости называется установившемся, стационарным, если скорости частиц в каждой точке потока со временем не изменяются (при этом условии линии тока совпадают с траекториями частиц жидкости).
- •9.Число Рейнольдса
- •13.Последовательное соединение трубок, 2 условия. Вывести формулу для гидравлического соединения последовательно соединенных трубок.
- •1.Закон Ома для переменного тока
- •2. Импеданс - это полное сопротивление в цепи переменного тока, т.Е. Его активная и реактивная составляющие. Обозначают импеданс буквой – z
- •10.Устройство и принцип действия
- •Структура усилителя
- •Каскады усиления
- •Режимы (классы) мощных усилительных каскадов
- •11.Обратная связь в усилителях
- •Амплитудно-частотная характеристика
- •12.Электронные осциллографы предназначены для визуального наблюдения и измерения параметров периодических электрических сигналов.
- •13.Электроды – это проводники специальной формы.Соединяющие измерительную цепь с биологической системой.
- •Резонанс электрических сигналов-
- •3.Рефрактометрия. Подробно объяснить ход опыта по определения показателя преломления прозрачной жидкости рефрактометром. Рефрактометрия
- •10.Характеристики теплового излучения
- •Абсолютно черное тело
- •Типы люминесценции
- •Спектры люминесценции.
- •7.Взаимодействие альфа-частиц с веществом
- •Взаимодействие бета-частиц с веществом
- •8.Взаимодействие рентгеновского и гамма излучения с веществом происходят посредством трех основных процессов: фотоэлектрического поглощения (фотоэффекта), рассеяния и эффекта образования пар.
- •18.3.2. Рассеяние рентгеновского и гамма излучения.
- •Система идентификации
Абсолютно черное тело
Энергетическая светимость тела RТ, численно равна энергии W, излучаемой телом во всем диапазоне длин волн (0<<) с единицы поверхности тела, в единицу времени, при температуре тела Т, т.е.
![]() (1)
(1)
Испускательная способность тела r,Т численно равна энергии тела dW, излучаемой телом c единицы поверхности тела, за единицу времени при температуре тела Т, в диапазоне длин волн от до +d, т.е.
![]() (2)
(2)
Эту величину называют также спектральной плотностью энергетической светимости тела.
Энергетическая светимость связана с испускательной способностью формулой
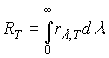 (3)
(3)
Поглощательная способность тела ,T - число, показывающее, какая доля энергии излучения, падающего на поверхность тела, поглощается им в диапазоне длин волн от до +d, т.е.
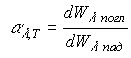 .
(4)
.
(4)
Тело, для которого ,T=1 во всем диапазоне длин волн, называется абсолютно черным телом (АЧТ).
Тело, для которого ,T=const<1 во всем диапазоне длин волн называют серым.
11. Особыми физическими приборами, называемыми актинометрами, можно измерить количество солнечной энергии, получаемой на земной поверхности на единицу площади в единицу времени. Прежде чем лучи Солнца достигнут поверхности Земли и попадут в актинометр, они должны пройти всю толщу нашей атмосферы, вследствие чего часть энергии будет поглощена атмосферой. Величина этого поглощения весьма колеблется в зависимости от состояния атмосферы, так что получаемое на земной поверхности количество солнечной энергии в разное время весьма различно.
Солнечной постоянной называется количество энергии, получаемое одним квадратным сантиметром площади, выставленной на границе земной атмосферы перпендикулярно к лучам Солнца, в одну минуту в малых калориях. Из большого ряда актинометрических наблюдений многих геофизических обсерваторий для солнечной постоянной было получено следующее значение:
А = 1,94 кал/см2 • мин.
На 1 квадратный метр обращенной к Солнцу поверхности площадки в окрестностях Земли ежесекундно поступает 1400 Дж энергии, переносимой солнечным электромагнитным излучением. Эта величина называется солнечной постоянной. Иными словами, плотность потока энергии солнечного излучения составляет 1,4 кВт/м2.
СОЛНЕЧНЫЙ СПЕКТР - распределение энергии электромагнитного излучения Солнца в диапазоне длин волн от нескольких долей нм (гамма-излучение) до метровых радиоволн. В видимой области солнечный спектр близок к спектру абсолютно черного тела при температуре около 5800 К; имеет энергетический максимум в области 430-500 нм. Солнечный спектр — непрерывный спектр, на который наложено более 20 тыс. линий поглощения (Фраунгоферовых линий) различных химических элементов.
Актинометр - прибор для измерения интенсивности прямой солнечной радиации. Принцип действия А. основан на поглощении падающей радиации зачернённой поверхностью и превращении её энергии в теплоту. А. является относительным прибором, т.к. об интенсивности радиации судят по различным явлениям, сопровождающим нагревание, в отличие от пиргелиометров — приборов абсолютных. Например, принцип действия актинометра Михельсона основан на нагревании солнечными лучами зачернённой сажей биметаллической пластинки 1, спрессованной из железа и инвара.При нагревании железо удлиняется, а инвар почти не испытывает теплового расширения, поэтому пластинка изгибается. Величина изгиба служит мерой интенсивности солнечной радиации. С помощью микроскопа наблюдают перемещение кварцевой нити, расположенной на конце пластинки.
1.Атомные спектры, оптические спектры, получающиеся при испускании или поглощении электромагнитного излучения свободными или слабо связанными атомами (например, в газах или парах). Являются линейчатыми, то есть состоят из отдельных спектральных линий, характеризуемых частотой излучения v, которая соответствует квантовому переходу между уровнями энергии Ei и Ek атома согласно соотношению: hv = Ei-Ek где h-постоянная Планка. Спектральные линии можно характеризовать также длиной волны = c/v (с - скорость света), волновым числом = v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1, длины волн - в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов - в эВ. Типичные атомные спектры наблюдаются в видимой, УФ- и ближней ИК-областях спектра. Спектры испускания, или эмиссионные, получают при возбуждении атомов различными способами (фотонами, электронным ударом и т.д.), спектры поглощения, или абсорбционные, - при прохождении электромагнитного излучения, обладающего непрерывным спектром, через атомарные газы или пары. Для наблюдения атомных спектров применяют приборы с фотографической или фотоэлектрической регистрацией.
Атомные спектры обладают ярко выраженной индивидуальностью: каждому элементу соответствует свой спектр нейтрального атома (так называемый дуговой спектр) и свои спектры последовательно образующихся положительных ионов (так называемые искровые спектры). Линии в этих спектрах обозначают римскими цифрами, например линии FeI, FeII, FeIII в спектрах железа соответствуют спектрам Fe, Fe+, Fe2+.
Вид спектра зависит как от электронного строения данного атома, так и от внешних условий - температуры, давления, напряженностей электрического и магнитного полей и т. п. В зависимости от способа возбуждения атома могут возникать отдельные линии спектра, некоторые его участки, весь спектр нейтрального атома или его иона определенной кратности. Положение линий в таких спектрах подчиняется определенным закономерностям, которые наиболее просты для атомов с одним внешним электроном, то есть для атома Н и нейтральных атомов щелочных металлов, а также изоэлектронных с ними ионов. В спектрах таких атомов наблюдаются спектральные серии, каждая из которых (в случае спектров испускания) получается при возможных квантовых переходах с последовательных вышележащих уровней энергии на один и тот же нижележащий (в спектрах поглощения – при обратных переходах). Промежутки между линиями одной серии убывают в сторону больших частот, то есть линии сходятся к границе серии - максимальной для данной серии частоте, соответствующей ионизации атома. Для атома Н волновые числа линий всех серий с большой точностью определяются обобщенной формулой Бальмера
В атомных спектрах проявляются не все возможные квантовые переходы, а лишь разрешенные правилами отбора. Так, в случае атома с одним внеш. электроном разрешены лишь переходы между уровнями, для которых орбитальное квантовое число l изменяется на 1 , т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями (l = 2) и т.д. Количественная характеристика разрешенного оптического квантового перехода - его вероятность, определяющая интенсивность спектральной линии, соответствующей этому переходу. Вероятности переходов в простейших случаях могут быть рассчитаны методами квантовой механики. Под влиянием внешних электрических и магнитных полей происходит расщепление спектральных линий. Возмущающие факторы, существующие в излучающей среде, вызывают уширение и сдвиг спектральных линий. Методы, основанные на измерении частот и интенсивностей линий в спектре, применяют для решения различных задач спектроскопии: проведения общей систематики спектров многоэлектронных атомов; определения уровней энергии таких атомов (это существенно, в частности, при квантово-химических расчетах); нахождения вероятностей переходов и времен жизни возбужденных состояний; изучения механизмов возбуждения атомов; измерения ядерных моментов и т. п. Индивидуальность атомные спектры используют для качественного определения элементного состава вещества, а зависимость интенсивности линий от концентрации излучающих атомов - для количественного анализа.
Методы молекулярной спектроскопии, основанные на изучении М. с., позволяют решать разнообразные задачи химии, биологии и др. наук (например, определять состав нефтепродуктов, полимерных веществ и т. п.). В химии по М. с. изучают структуру молекул. Электронные М. с. дают возможность получать информацию об электронных оболочках молекул, определять возбуждённые уровни и их характеристики, находить энергии диссоциации молекул (по схождению колебательных уровней молекулы к границам диссоциации). Исследование колебательных М. с. позволяет находить характеристические частоты колебаний, соответствующие определённым типам химических связей в молекуле (например, простых двойных и тройных связей С-С, связей С-Н, N-Н, О-Н для органических молекул), различных групп атомов (например, CH2, CH3, NH2), определять пространственную структуру молекул, различать цис- и транс-изомеры. Для этого применяют как инфракрасные спектры поглощения (ИКС), так и спектры комбинационного рассеяния (СКР). Особенно широкое распространение получил метод ИКС как один из самых эффективных оптических методов изучения строения молекул. Наиболее полную информацию он даёт в сочетании с методом СКР. Исследование вращательных М. с., а также вращательной структуры электронных и колебательных спектров позволяет по найденным из опыта значениям моментов инерции молекул [которые получаются из значений вращательных постоянных, см. (7)] находить с большой точностью (для более простых молекул, например H2O) параметры равновесной конфигурации молекулы - длины связей и валентные углы. Для увеличения числа определяемых параметров исследуют спектры изотопических молекул (в частности, в которых водород заменен дейтерием), имеющих одинаковые параметры равновесных конфигураций, но различные моменты инерции.В качестве примера применения М. с. для определения химического строения молекул рассмотрим молекулу бензола C6H6. Изучение её М. с. подтверждает правильность модели, согласно которой молекула плоская, а все 6 связей С-С в бензольном кольце равноценные и образуют правильный шестиугольник (рис. 2, б), имеющий ось симметрии шестого порядка, проходящую через центр симметрии молекулы перпендикулярно её плоскости. Электронный М. с. поглощения C6H6 состоит из нескольких систем полос, соответствующих переходам из основного чётного синглетного уровня на возбуждённые нечётные уровни, из которых первый является триплетным, а более высокие - синглетными (рис. 5). Наиболее интенсивна система полос в области 1840 ?(E5 - E1= 7,0 эв), наиболее слаба система полос в области 3400 ?(E2 - E1 = 3,8 эв), соответствующая синглетно-триплетному переходу, запрещенному приближёнными правилами отбора для полного спина. Переходы соответствуют возбуждению т. н. p-электронов, делокализованных по всему бензольному кольцу (см. Молекула); полученная из электронных молекулярных спектров схема уровней рис. 5 находится в согласии с приближёнными квантовомеханическими расчётами. Колебательные М. с. C6H6 соответствуют наличию в молекуле центра симметрии - частоты колебаний, проявляющиеся (активные) в ИКС, отсутствуют (неактивные) в СКР и наоборот (т. н. альтернативный запрет). Из 20 нормальных колебаний C6H6 4 активны в ИКС и 7 активны в СКР, остальные 11 неактивны как в ИКС, так и в СКР. Значения измеренных частот (в см-1): 673, 1038, 1486, 3080 (в ИКС) и 607, 850, 992, 1178, 1596, 3047, 3062 (в СКР). Частоты 673 и 850 соответствуют неплоским колебаниям, все остальные частоты - плоским колебаниям. Особо характерны для плоских колебаний частота 992 (соответствующая валентному колебанию связей С-С, состоящему в периодическом сжатии и растяжении бензольного кольца), частоты 3062 и 3080 (соответствующие валентным колебаниям связей С-Н) и частота 607 (соответствующая деформационному колебанию бензольного кольца). Наблюдаемые колебательные спектры C6H6 (и аналогичные им колебательные спектры C6D6) находятся в очень хорошем согласии с теоретическими расчётами, позволившими дать полную интерпретацию этих спектров и найти формы всех нормальных колебаний.Подобным же образом можно при помощи М. с. определять структуру разнообразных классов органических и неорганических молекул, вплоть до весьма сложных, например молекул полимеров.
Многоэлектронные атомы. В многоэлектронных атомах помимо кулоновского взаимодействия каждого Э с ядром имеются также взаимодействия Э друг с другом и обменное взаимодействие, связанное с неразличимостью Э при их квантовомеханическом описании. Движение каждого из Э можно рассматривать происходящим в нек-ром усредненном поле, создаваемом ядром и всеми др. Э. Для приближенного описания можно использовать квантовые числа n и l, однако в данном случае вырождение по l отсутствует даже в нерелятивистском приближении. Тем не менее каждый У.э. с данными n и l еще остается вырожденным по проекции орбитального и спинового МКД. Кратность этого вырождения равна (2s+1)(2l+1)=2(2l+1), т.к. для электрона s=1/2. Согласно принципу Паули, в каждом из этих состояний может находится только по одному Э. Поэтому максимально возможное число состояний в А с данными n и l равно 2(2l+1) и эти состояния, называемые эквивалентными, образуют электронную оболочку. Электронная оболочка наз. замкнутой, если все возможные состояния в ней заполнены. Совокупность 2n2 состояний с одним и тем же n, но разными l наз. электронным слоем (напр., K-слой, содержащий 2 Э при n=1, L-слой, содержащий 8 Э при n=2, M-слой, содержащий 18 Э при n=3). закономерностями в последовательном заполнении электронных оболочек объясняется периодичность изменения св-в элементов. Последовательность, в к-рой возрастают энергии Э с заданными n и l, следующая: 1s, 2s, 2p, 3s, 3p, 3d, ... и т.д. (здесь буквы лат. алфавита, как и ранее, относятся к значениям орбитального МКД l=0, 1, 2, ...). Совокупность всех атомных Э, находящихся в определенных энергетич. состояниях, наз. электронной конфигурацией А. Для ее описания указывают, каким образом при возрастании n Э рапределяются по оболочкам. Для этого перечисляют все электронные оболочки, в к-рых есть Э, а именно: указывают главное квантовое число n, лат. буквуЮ соответствующую значению орбитального МКД l, и (сверху справа от этой буквы) число Э в данной оболочке. Напр., конфигурация 1s2 2s2 2p2 осн. состояния А углерода означает, что в первом электронном слое находится два s-электрона, во втором слое находится два Э в s-оболочке и два Э в p-оболочке. Электронная конфигурация определяет энергию А лишь приближенно. Для дальнейшего уточнения этой величины необходимо знать, какой тип связи МКД Э реализуется
Энергетические уровни молекул Основные типы движений в молекулах.В общем случае в молекуле (М) имеется три типа движений: электронное, колебательное и вращательное. Движение каждого Э в М происходит в электрическом поле атомных ядер и в поле всех других Э. Так же как и в атомах в М электроны образуют вполне определенные конфигурации, а электронная энергия квантуется. Состояние М, соответствующее определенному значению , наз. электронным состоянием. В отличие от атомов, в М в каждом электронном состоянии не явл. определенной постоянной величиной, но зависит от межъядерных расстояний (длин связи) и углов между ними (валентных углов). Эта функциональная зависимость наз. поверхностью потенциальной энергии (или кривой потенциальной энергии для двух атомной М). Поверхность потенциальной энергии, соответствующая связанному состоянию М, имеет минимум при некоторых значениях длин связи и валентных углов - эти значения наз. равновесными. Классификация электронных состояний многоатомных М проводится методами теории групп.
Наиболее простыми системами с точки зрения классификации энергетических состояний явл. линейные, или двухатомные М. В линейной М электрическое поле, действующее на Э, обладает аксиальной симметрией. Поэтому каждое электронное состояние характеризуется определенным значением проекции суммарного орбитального МКД всех Э на ось М. Эта величина обозначается . Различным значениям абс. величины соответствуют различные электронные состояния, или термы, к-рые обозначаются большими буквами греч. алфавита: -состояние, -состояние, -состояние и т.д. Электронные состояния характеризуются также суммарным спином всех электронов S. Спин-орбитальное взаимодействие приводит к расщеплению электронного терма с данным S на 2S+1 близко лежащих У.э. (тонкая структура). Число 2S+1 наз. мультиплетностью электронного терма и ставится слева вверху у греч. буквы, указывающей значение , напр., , . Опыт показывает, что осн. электронное состояние большинства М есть -состояние. Существует, однако, ряд М, в т.ч. такие межзвездные М как OH, NO, CH, осн. состояние к-рых характеризуется отличными от нуля значениями L или/и S. При возможны два состояния с одинаковой энергией, отличающиеся знаком проекции орбиального МКД на ось М (). Т.о., все состояния с двухкратно вырождены. -состояния не вырождены. Различают - и -состояния. Знаки обозначают четность состояния по отношению к операции отражения в плоскости, содержащей ось М. Если М обладает центром симметрии (напр., H2, O2, CO2, H2C2), то появляется дополнит. квантовое число - четность по отношению к инверсии пространства. Четные состояния обозначают индексом , а нечетные - индеском . Осн. св-ва кривых потенциальной энергии иллюстрируются рис. 3, где показаны такие кривые для трех электронных состояний молекулы H2 - (для наглядности масштабы по осям энергии и межъядерных расстояний не выдержаны точно). Кривые для состояний имеют минимумы при равновесных межъядерных расстояниях R=Re и соответствуют связанным состояниям М. При оба атома водорода свободны и Eэл равна сумме энергий обоих атомов. Величина наз. границей диссоциации. При сближении атомов образуется устойчивая М. Когда R < Re, потенциальная энергия растет, т.к. начинает сказываться кулоновское отталкивание ядер. Разность энергий наз. энергией диссоциации. Кривая потенциальной энергии для состояния не имеет минимума, т.е. это состояние не явл. связанным. Сближающиеся атомы с таким набором квантовых чисел после столкновения расходятся, и М не образуется. Колебания молекулы.
2. Люминесценция (от лат. lumen, род. падеж luminis — свет и -escent — суффикс, означающий слабое действие) — нетепловое свечение вещества, происходящее после поглощения им энергии возбуждения. Впервые люминесценция была описана в XVIII веке.Первоначально явление люминесценции использовалось при изготовлении светящихся красок и световых составов на основе так называемых фосфоров, для нанесения на шкалы приборов, предназначенных для использования в темноте. Особого внимания в СССР люминесценция не привлекала вплоть до 1948 года, когда советский учёный С. И. Вавилов на сессии Верховного совета предложил начать изготовление экономичных люминесцентных ламп и использовать люминесценцию в анализе химических веществ. В быту явление люминесценции используется чаще всего в люминесцентных лампах «дневного света» и электронно-лучевых трубках кинескопов. На использовании явления люминесценции основано явление усиления света, экспериментально подтверждённое работами В. А. Фабриканта и лежащее в основе научно-технического направления квантовой электроники, конкретно находящее своё применение в усилителях света и генераторах стимулированного излучения (лазерах).«Будем называть люминесценцией избыток над температурным излучением тела в том случае, если это избыточное излучение обладает конечной длительностью примерно 10−10 секунд и больше». Таково каноническое определение люминесценции, данное русским учёным С. И. Вавиловым в 1948 году. Это значит, что яркость люминесцирующего объекта в спектральном диапазоне волн его излучения существенно больше, чем яркость абсолютно чёрного тела в этом же спектральном диапазоне, имеющего ту же температуру, что и люминесцирующее тело.
Первая часть определения позволяет отличить люминесценцию от теплового излучения, что особенно важно при высоких температурах, когда термоизлучение приобретает большую интенсивность. Важной особенностью люминесценции является то, что она способна проявляться при значительно более низких температурах, так как не использует тепловую энергию излучающей системы. За это люминесценцию часто называют «холодным свечением». Критерий длительности, введённый Вавиловым, позволяет отделить люминесценцию от других видов нетеплового излучения: рассеяния и отражения света, комбинационного рассеяния, излучения Черенкова. Длительность их меньше периода колебания световой волны (то есть <10−10 c).Физическая природа люминесценции состоит в излучательных переходах электронов атомов или молекул из возбуждённого состояния в основное. При этом причиной первоначального их возбуждения могут служить различные факторы: внешнее излучение, температура, химические реакции и др.
Вещества, имеющие делокализованные электроны (сопряжённые системы), обладают самой сильной люминесценцией. Антрацен, нафталин, белки, содержащие ароматические аминокислоты и некоторые простетические группы, многие пигменты растений и в частности хлорофилл, а также ряд лекарственных препаратов обладают ярко выраженной способностью к люминесценции. Органические вещества, способные давать люминесцирующие комплексы со слабо люминесцентными неорганическими соединениями, часто используются в люминесцентном анализе. Так, в люминесцентной титриметрии часто применяется вещество флуоресцеин.Первоначально понятие люминесценция относилось только к видимому свету. В настоящее время оно применяется к излучению в инфракрасном, видимом, ультрафиолетовом и рентгеновском диапазонах (см. шкала электромагнитных волн).Многие формы природной люминесценции были известны людям очень давно. Например, свечение насекомых (светлячки), свечение морских рыб и планктона, полярные сияния, свечение минералов, гниющего дерева и других разлагающихся органических веществ. В настоящее время к природным формам прибавилось много искусственных способов возбуждения люминесценции. Твердые и жидкие вещества, способные люминесцировать, называют люминофорами (от лат. lumen — свет и др.-греч. phoros — несущий).Чтобы вещество было способно люминесцировать, его спектры должны иметь дискретный характер, то есть его энергетические уровни должны быть разделены зонами запрещенных энергий. Поэтому металлы в твёрдом и жидком состоянии, обладающие непрерывным энергетическим спектром, не дают люминесценции. Энергия возбуждения в металлах непрерывным образом переходит в тепло. И лишь в коротковолновом диапазоне металлы могут испытывать рентгеновскую флуоресценцию, то есть под действием рентгеновского излучения испускать вторичные Х-лучи.
