- •Окислительно-восстановительные процессы
- •Введение
- •1 Теоретическая часть
- •Классификация химических реакций
- •Определение степени окисления элементов в соединениях
- •1.3 Окислительно-восстановительные свойства элементов
- •1.4 Подбор коэффициентов в окислительно-восстановительных реакциях
- •1.5 Зависимость реакций окисления-восстановления от среды
- •1.6 Направление протекания окислительно-
- •1.7 Гальванический элемент Даниеля-Якоби
- •1.8 Стандартный водородный электрод. Стандартные
- •1.9 Уравнение Нернста
- •1.10 Электролиз
- •1.10.1 Законы электролиза (м. Фарадей)
- •1.11 Коррозия металлов
- •1.11.1 Электрохимическая коррозия
- •2 Экспериментальная часть
- •3 Техника безопасности
- •4 Контрольные вопросы для допуска к лабораторной работе
- •5 Карточки для защиты лабораторной работы
- •5.2 Основные понятия и определения
- •5.3 Подготовка к лабораторному занятию
- •Приложение а Стандартные потенциалы металлических и газовых электродов
- •Приложение б Стандартные потенциалы окислительно-восстановительных пар
- •Окислително- восстановительный потенциал – потенциал, устанавливающийся в условиях равновесия электродной реакции.
- •Реакции диспропорционирования – реакции самоокисления и самовосстановления:
- •Сферолиты – игольчатые образования, радиально расходящиеся из одного центра.
- •Электрон-донорно-акцепторные реакции – окислительно-восстановительные реакции.
- •Приложение г Тесты по теме "Окислительно-восстановительные процессы"
- •Литература
- •Приложение г Тесты по теме "Окислительно- восстановительные процессы",,…………………………………...52
1.11.1 Электрохимическая коррозия
Рассмотрим коррозию железа как электрохимический процесс. Ржавление железа есть не что иное, как анодная реакция
-
* Часто применяют так называемую анодную защиту, при этом потенциал корродирующего металла специальными способами сдвигают в область пассивации.

|
|
|
Катодная реакция – восстановление атмосферного кислорода:
|
|
|
Водородные ионы поставляет вода. Если бы в воде не было растворенного кислорода, то коррозия была бы невозможна. Следовательно, железо корродирует в слое воды, насыщенном кислородом. Таким образом, начальную стадию коррозии железа можно передать реакцией
|
2Fe + O2 + 4H+ → 2FeO + 2H2O. |
|
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение концентрации ионов водорода pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9…10 коррозия железа практически прекращается. Известно, что в водной среде ионы Fe2+ в присутствии кислорода окисляются до Fe3+. Вторая стадия коррозии соответствует реакции образования гидратированного оксида железа (ржавчины) Fe2O3∙nH2O:
|
4Fe2+ + O2 + 4H2O + xH2O = 2Fe2O3∙xH2O + 8H+. |
|
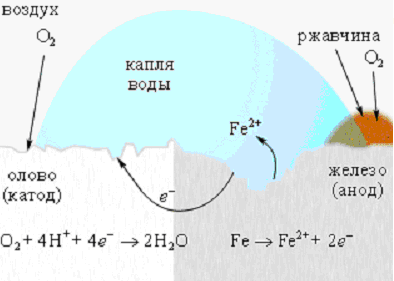
Для защиты железа от коррозии используются всевозможные покрытия: краска, слой металла (олова, цинка). При этом краска и олово предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности железа, и процесс коррозии возобновляется, причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (рисунок 4).
|
|
Рисунок 4 -Коррозия железа кислородом воздуха, растворенным в воде. |
|
|
|
Рисунок 5 - Коррозия «белой жести» |
|
Оцинкованное железо ведет себя иначе. Поскольку цинк выполняет роль анода, то его защитная функция сохраняется и при нарушении цинкового покрытия (рисунок 6).
|
Рисунок 6 - Катодная защита в оцинкованном железе |
Катодная защита широко используется для уменьшения коррозии подземных и подводных трубопроводов и стальных опор высоковольтных передач, нефтяных платформ и причалов.
-
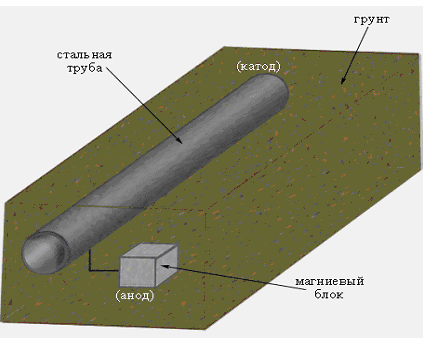
Рисунок 7 - Катодная защита подземного трубопровода.
2 Экспериментальная часть
Цель работы
1) исследовать окислительные свойства соединений в высших, низших и промежуточных степенях окисления;
2) изучить влияние величины рН на состав продуктов окислительно-восстановительной реакции.
Опыт 1. Вытеснение металлов из солей другими металлами
Железную проволоку или железный гвоздь опустить в пробирку с раствором сульфата меди на 1…2 минуты. Вынуть. Сполоснуть водой. Обратить внимание на происходящее явление и написать уравнение реакции.
Внимание: после опыта слейте растворы в емкость «для слива»!
Вопросы и задания:
1) опишите наблюдаемое явление.
2) напишите уравнения химических реакции и расставьте коэффициенты методом электронного баланса;
3) рассчитайте стандартные значения DЕ0э , DG , Кр реакции;
4) сделайте выводы.
Опыт 2. Окисление азотной кислотой
В пробирку положить несколько кусочков медной стружки и прилить разбавленную азотную кислоту.
Вопросы и задания:
1) опишите наблюдаемое явление;
2) напишите уравнения химических реакций и расставьте коэффициенты методом электронного баланса;
3) рассчитайте стандартные значения DЕ0э , DG0 и Кр;
4) сделайте выводы.
Опыт3. Окислительные свойства MnO4- в различных средах
а). Проведите реакцию между сульфатом железа (соль Мора), перманганатом калия в кислой среде – добавьте серной кислоты. Что наблюдаете?
FeSO4 + KMnO4 +H2S O4 ® K2S O4 + Fe2(S O4)3 + MnSO4 +H2O
б). проведите реакцию между сульфатом железа, перманганатом калия в щелочной среде. В чем разница между этими реакциями? В какой среде Mn7+ проявляет большие окислительные свойства?
FeSO4 + KMnO4 +KOH ® K2SO4 + Fe(OH)3 + К2MnO4
Вопросы и задания:
1) опишите наблюдаемое явление;
2) напишите уравнение химической реакции и расставьте коэффициенты методом электронного баланса;
3) как влияет среда на состав продуктов реакции?
4) рассчитайте стандартные значения DЕ0э , DG0 и Кр.
Опыт 4. Окислительно-восстановительные свойства хрома в высших и низших степенях окисления
а). Восстановление Cr6+ ® Cr3+
К раствору KI прилейте разбавленную серную кислоту и раствор бихромата калия.
KJ + H2SO4 + K2Cr2O7 ® Cr2 (SO4)3 + K2SO4 + J2 + H2O
б). Окисление Cr3+ ® Cr6+
К раствору сульфата хрома прилейте раствор щёлочи KOH до растворения осадка, затем добавьте раствор перманганата калия. Нагрейте.
Cr2 (SO4)3 +KOH + KMO4 ® K2SO4 +K2CrO4 + MnO2 + H2O
Вопросы и задания:
1) опишите наблюдаемое явление;
2) напишите уравнение химических реакций и расставьте коэффициенты методом электронного баланса;
3) приведите три примера веществ, проявляющих как свойства окислителя, так и восстановителя;
4) рассчитайте стандартные значения DЕ0э , DG0 и Кр.
5) сделайте выводы.