
- •Окислительно-восстановительные процессы
- •Введение
- •1 Теоретическая часть
- •Классификация химических реакций
- •Определение степени окисления элементов в соединениях
- •1.3 Окислительно-восстановительные свойства элементов
- •1.4 Подбор коэффициентов в окислительно-восстановительных реакциях
- •1.5 Зависимость реакций окисления-восстановления от среды
- •1.6 Направление протекания окислительно-
- •1.7 Гальванический элемент Даниеля-Якоби
- •1.8 Стандартный водородный электрод. Стандартные
- •1.9 Уравнение Нернста
- •1.10 Электролиз
- •1.10.1 Законы электролиза (м. Фарадей)
- •1.11 Коррозия металлов
- •1.11.1 Электрохимическая коррозия
- •2 Экспериментальная часть
- •3 Техника безопасности
- •4 Контрольные вопросы для допуска к лабораторной работе
- •5 Карточки для защиты лабораторной работы
- •5.2 Основные понятия и определения
- •5.3 Подготовка к лабораторному занятию
- •Приложение а Стандартные потенциалы металлических и газовых электродов
- •Приложение б Стандартные потенциалы окислительно-восстановительных пар
- •Окислително- восстановительный потенциал – потенциал, устанавливающийся в условиях равновесия электродной реакции.
- •Реакции диспропорционирования – реакции самоокисления и самовосстановления:
- •Сферолиты – игольчатые образования, радиально расходящиеся из одного центра.
- •Электрон-донорно-акцепторные реакции – окислительно-восстановительные реакции.
- •Приложение г Тесты по теме "Окислительно-восстановительные процессы"
- •Литература
- •Приложение г Тесты по теме "Окислительно- восстановительные процессы",,…………………………………...52
1.7 Гальванический элемент Даниеля-Якоби
Простая электрохимическая ячейка, называемая элементом Даниеля по фамилии изобретателя Джона Даниеля, состоит из двух половин, называемых полуэлементами или полуячейками, одна из которых содержит медную полоску, погруженную в водный раствор сульфата меди(II), а другая содержит цинковую фольгу, помещенную в водный раствор сульфата цинка(II). Растворы соединены друг с другом солевым мостиком, содержащим желатин с раствором хлорида калия или нитрата калия, что позволяет ионам перемещаться между двумя полуэлементами, но не способствует слишком быстрому перемешиванию растворов, содержащих ионы меди(II) и цинка(II). Металлические полоски соединяются электропроводящей проволокой, а в цепь может быть включен вольтметр.
Когда металл помещается в раствор, содержащий ионы этого металла (например, медь в растворе сульфата меди(II)), достигается состояние равновесия и возникает электрический потенциал, являющийся следствием установления равновесия.
Сочетание меди и ионов меди(II) называется окислительно-восстановительной парой; существует возможность или восстановить медь(II) до меди, или окислить медь до ионов меди(II).
Способность меди(II) к восстановлению сильнее, чем у цинка(II). Это легко продемонстрировать, помещая кусок металлической меди в раствор, содержащий ионы цинка(II), а помещая полоску металлического цинка в другом стакане с раствором, содержащим ионы меди(II). В первом стакане реакция не происходит, а во втором цинк окисляется и осаждается металлическая медь в результате восстановления ионов меди(II). Реакция происходит самопроизвольно:
Zn(TB.) +
Сu2+(водн.)
![]() Zn 2+(водн.) + Сu(tb.)
.
Zn 2+(водн.) + Сu(tb.)
.
Когда два полуэлемента Даниеля соединены, как показано на рисунке 1, реакция происходит несмотря на то, что реагенты не находятся в непосредственном контакте. Возникает разность электрических потенциалов между двумя полуэлементами (которая может быть измерена вольтметром), и в проволоке возникает ток электронов из одного полуэлемента в другой по мере протекания реакции. Ток электронов направлен от цинковой к медной фольге, т. е. электроны высвобождаются в цинковом полуэлементе и потребляются в медном полуэлементе:
Zn –2e ® Zn2+ .
Процессы окисления в электрохимии называют анодными процессами, а электроды, на которых идут процессы окисления – анодами:
Cu2+ + 2e ® Cu .
Процессы восстановления называют катодными процессами, а электроды, на которых идут процессы восстановления, называют катодами.
Электрический контур замыкается при прохождении ионов через солевой мостик.
Вся электрохимическая ячейка представляется диаграммой ячейки:
Zn(тв.)|Zn2+(водн.)||Сu2+(водн.)|Сu(тв.) .
где одинарные вертикальные линии обозначают межфазные границы, а двойная вертикальная линия - солевой мостик. Самопроизвольный процесс протекает слева направо на диаграмме ячейки — металлический цинк превращается в ионы цинка(II), а ионы меди(II) превращаются в металлическую медь. Процесс восстановления всегда обозначен в правой части диаграммы ячейки.
Разность потенциалов между двумя полуячейками (полуэлементами) обозначается DE, и это значение (в вольтах) напрямую связано с изменением энергии Гиббса для всей реакции (уравнение 1.1).
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой элемента (э.д.с.).
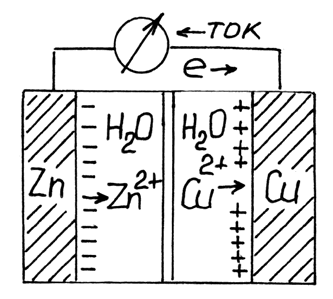
Рисунок 1- Гальванический элемент Даниеля-Якоби
Количественной мерой окислительной способности окислителя (и одновременно восстановительной способности его восстановленной формы) является электрический потенциал электрода Е (электродный потенциал), на котором одновременно и с равными скоростями протекают полуреакция его восстановления и обратная ей полуреакция окисления соответствующей восстановленной формы.
Для протекания реакции в прямом направлении движущая сила реакции - ЭДС гальванического элемента должна быть положительной, т.е. DE > 0, т.к. энергия Гиббса DG должно быть отрицательно:
DE = Еокислителя- Евосстановителя > 0 . (1.2)
Для протекания окислительно-восстановительной реакции в прямом направлении потенциал окислителя должен быть больше потенциала восстановителя.
