
- •Степин б. Д
- •Глава 1
- •Глава 2
- •Глава 3
- •Глава 4
- •Глава 5
- •Глава 6
- •Глава 7
- •Глава 8
- •Глава 9
- •Глава 10
- •Глава 11
- •Глава 12
- •Глава 13
- •Глава 14
- •Глава 1
- •1.1. Стекло
- •1.2. Керамика, керметы, графит и асбест
- •1.3. Полимерные материалы
- •1.4. Металлы
- •1.5. Материалы для фильтрования
- •1.6. Резина и каучуки (пробки и шланги)
- •1.7. Смазки, замазки и уплотняющие средства
- •1.8. Вода
- •1.9. Ртуть
- •1.10. Монтажные приспособления, крепежные изделия и амортизаторы
- •Глава 2
- •2.1. Химические стаканы, колбы и реторты
- •2.2. Колокола, колпаки, склянки и пробирки
- •2.3. Промывалки, эксикаторы и сосуды Дьюара
- •2.4. Краны, зажимы, клапаны, затворы каплеуловители
- •2.5. Сифоны, переходные трубки, алоюки, шлифы, стеклянные трубки и капилляры
- •2.6. Делительные и капельные воронки, ампулы и бюксы
- •2.7. Холодильники
- •2.8. Ступки, чашки, тигли, лодочки и шпатели
- •2.9. Очистка и сушка химической посуды
- •Глава 3
- •3.1. Технохимические весы
- •3.2. Аналитические весы
- •3.3. Гидростатические весы
- •3.4. Газовые и торзионные (крутильные) весы
- •3.5. Специальные весы
- •3.6. Весовая комната
- •Глава 4
- •4.1. Мерные цилиндры, мензурки и другая мерная посуда
- •4.2. Мерные колбы и пикнометры
- •4.3. Пипетки
- •4.4. Бюретки
- •4.6. Определение плотности жидких и твердых веществ
- •Глава 5
- •5.1. Ртутные термометры
- •5.2. Газовые тензиметрические термометры
- •5.3. Паровые и жидкостные манометрические термометры
- •5.4. Термометры сопротивления
- •5.5. Термисторы
- •5.6. Термопары
- •5.7. Пирометры
- •5.8. Конусы Зегера (керамические пироскопы)
- •5.9. Регулирование температуры
- •5.10. Термостаты
- •5.11. Криостаты
- •Глава 6
- •6.4. Инфракрасные излучатели
- •6.6 Электропечи
- •6.7. Индукционные печи
- •6.8. Высокочастотные диэлектрические нагреватели
- •6.9. Газовые печи
- •6.10. Сушильные шкафы
- •6.11. Средства и приборы для охлаждения
- •6.12. Теплоизоляция
- •Глава 7
- •7.1. Измельчение
- •7.2. Высушивание и прокаливание порошков
- •7.3. Просеивание сухих порошков
- •7.4. Смешивание порошков
- •7.5. Хранение
- •7.6. Возгонка (сублимация) и десублимация
- •7.8. Определение температуры плавления
- •7.9. Измерение степени влажности
- •Глава 8
- •8.2. Перекачивание жидкости
- •8.3. Удаление влаги и растворенных газов из органических жидкостей
- •8.4. Перегонка жидкостей (дистилляция)
- •8.5. Молекулярная перегонка
- •8.6. Элементарная техника жидкостной экстракции
- •8.7. Определение температур кипения жидкостей
- •8.8. Капиллярные вискозиметры
- •8.9. Хранение жидкостей
- •Глава 9
- •9.1. Растворение.
- •9.2. Перемешивание
- •9.3. Выпаривание и концентрирование растворов
- •9.5. Промывание осадков
- •9.6. Кристаллизация веществ из растворов
- •9.7. Кристаллизация вещества из расплава
- •9.8. Выращивание монокристаллов
- •9.9. Экстракция примесей из смеси твердых фаз
- •9.10. Определение молярной массы вещества-неэлектролита
- •Глава10. Эксперименты с газами
- •10.1. Приборы для получения газов
- •10.2. Приборы для реакций газов с твердыми веществами
- •10.3. Очистка и осушка газов
- •10.4. Измерение давления газа
- •2 • 104 Па (150 торр).
- •10.5. Измерение давления пара вещества
- •10.6. Регулирование давления
- •10.7. Измерение расхода газа
- •10.8. Получение вакуума и избыточного давления
- •10.9. Ловушки для конденсации газов
- •10.10. Хранение газов
- •10.11. Измерение плотности и объема газов
- •10.12. Определение влажности газов
- •Глава 11. Электрохимические исследования и синтезы
- •11.2. Химические источники тока и электроды
- •11.3. Измерения водородного показателя
- •11.4. Электролиз
- •11.5. Электрический разряд в газах
- •11.6. Электродиализ
- •Глава 12
- •12.2. Автоклавы
- •12.3. Компрессоры
- •Глава 13
- •13.1. Микрососуды, микропипетки и пластинки
- •13.2. Градуированные микропипетки, микробюретки и микромерные колбы
- •13.3. Нагревание
- •13.4. Перемешивание и измельчение
- •13.5. Растворение, выпаривание и высушивание
- •13.6. Фильтрование
- •13.7. Перегонка и возгонка
- •13.8. Экстракция
- •13.9. Определение температур плавления и кипения
- •13.10. Определение плотности
- •Глава 14
- •14.1. Источники света
- •14.2. Жидкостные, стеклянные и интерференционные светофильтры
- •14.3. Фотохимические реакторы
Глава10. Эксперименты с газами
В лабораторной практике довольно часто применяют газы. Их используют для синтеза веществ и создания защитной атмосферы в зоне реакции, предохраняющей реагенты от воздействия компонентов воздуха. Газы в процессе работ сжимают, превращают в жидкое состояние, от них освобождают сосуды, если нужен вакуум. Для получения газов и их хранения требуются специальные приборы. Много трудностей возникает у исследователя при очистке газов от примесей. Можно сказать, что эксперименты с газами по сравнению с опытами, в которых используют твердые и жидкие вещества, являются наиболее сложными в техническом отношении.
10.1. Приборы для получения газов
Для получения газов применяют большое число самых разнообразных приборов, которые можно условно разделить на четыре группы: 1) приборы для взаимодействия твердых веществ с жидкостью, подводимой к веществу снизу; 2) приборы капельного действия; 3) приборы для взаимодействия жидкости с жидкостью и 4) приборы, в которых газ образуется при термическом разложении твердого вещества.
Приборы с подводом жидкого реагента снизу (рис. 228 и 229).
 0011
Одним из таких приборов является прибор
Винклера (рис. 228, а).
0011
Одним из таких приборов является прибор
Винклера (рис. 228, а).
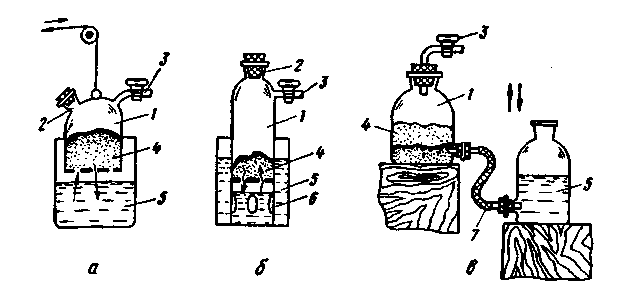
Рис. 228. Приборы для получения газов подводом жидкости к твердому веществу снизу: Винклера (а), Гей-Люссака (б) и Сент-Клер-Девилля - Дебре (в)
Чтобы получить газ, сосуд 1 с перфорированным дном, содержащий твердый реагент 4,
опускают механическим приспособлением в жидкость 5, а затем извлекают из нее, когда
газ уже не нужен. Перед извлечением сосуда 1 кран на трубке 3 закрывают. Недостаток
этого прибора - возможность проникновения воздуха в сосуд через перфорированное дно,
когда прибор находится в нерабочем состоянии. Штуцер 2 служит для загрузки и
выгрузки сосуда.
Винклер Клеменс Александр (1838 - 1904) - немецкий химик. Описанный прибор создан в 1882 г.
В приборе Гей-Люссака (рис. 228,б) газовая камера 1 с перфорированным дном и отверстиями 6 постоянно находится в жидкости 5. Когда надобность в получении газа отпадает, закрывают кран на трубке 3, и газ вытесняет жидкость через твердый реагент 4 и перфорированное дно в нижнюю часть камеры 7, а оттуда через боковые отверстия 6 - в сосуд 5 с жидкостью. Через тубус 2 происходит загрузка и разгрузка прибора.
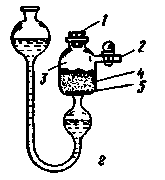
Наиболее простым из всех приборов первой группы является прибор Дебре и Сент-Клер-Девилля (рис. 228,в), напоминающий прибор Винклера. Прибор состоит из двух склянок 1 и 5 c нижними тубусами. В склянку 1 помешают на дно слой из стеклянной или полимерной ваты, а на этот слой - твердое вещество 4. В склянку 5 заливают жидкий реагент. При поднятии склянки 5 реагент проникает через резиновый шланг 7 и слой ваты к твердому веществу и вступает с ним в реакцию с выделением газа, выходящего через кран 3. Когда газ не нужен, склянку с жидкостью опускают вниз, удаляя тем самым жидкость из твердого вещества. Остатки жидкости выдавливаются избыточным давлением газа. В этом приборе отработанную жидкость можно легко заменить свежей.
Дебре Анри Жюль (1827-1888) - французский химик-неорганик. Участвовал в изготовлении международных эталонов длины и массы - метра и килограмма
Сент-Клер-Девилль Анри Этьен (1818-1881) - французский химик-неорганик. Вместе с Дебре изготовил эталоны метра и килограмма.
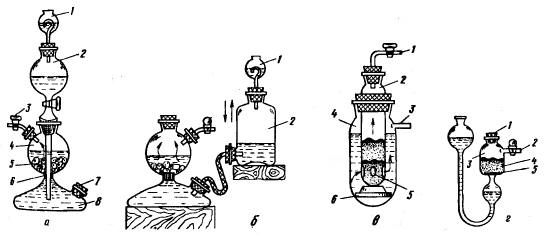
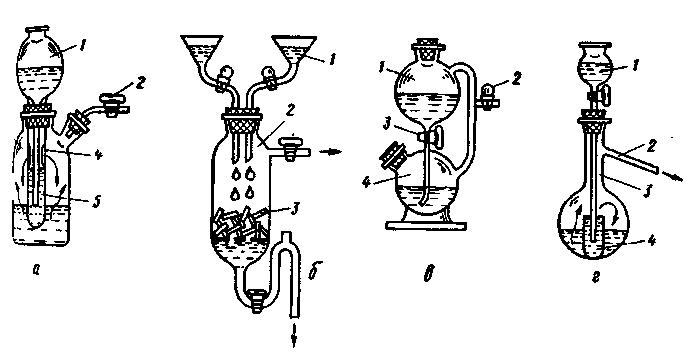
Аппарат Киппа широко используется почти во всех лабораториях. Он состоит из колбы-реактора 4 (рис. 229, а), в которую, вынув верхнюю воронку 2, загружают кусочки твердого реагента 5. В нижнюю часть колбы вставлен вкладыш 6 в виде стеклянного конуса с волнистой боковой поверхностью. Вкладыш предотвращает попадание частиц твердого реагента 5 в нижний резервуар 8.
После загрузки твердого вещества в колбу 4 воронку 2 ставят на место, смазав предварительно одной из смазок, рекомендованных в разд. 1.7, шлифованные поверхности. Через воронку наливают в аппарат жидкий реагент в таком количестве, чтобы колба 4 была заполнена наполовину, при этом кран выпуска газа 3 должен быть открыт. Образующийся газ выпускают из колбы в течение 5-10 мин для полного вытеснения воздуха Затем кран закрывают, и жидкость под давлением все еще образующегося газа вытесняется через резервуар 8 в воронку 2. В этой операции кран под воронкой должен быть открыт.
Пробка 7 резервуара 8 нужна для удаления из аппарата отработанной жидкости. Эта пробка вызывает часто неудобства в работе - подтекает или не открывается. Поэтому она должна быть тщательно пришлифована и смазана. Ее обычно закрепляют сильными пружинами, если у тубуса пробки 7 есть стеклянные крючки. При их отсутствии пробку надежно укрепляют проволокой.
Чтобы воспрепятствовать выходу газа и паров жидкого реагента, воронку 2 закрывают предохранительным сосудом 1, заполненным небольшим количеством воды.
Для разборки аппарата при смене реагентов сначала открывают пробку 7 и сливают жидкость. Затем заливают аппарат одой через воронку 2 и дают возможность воде промыть сосуды 2, 4 и 8, и снова воду спускают через тубус пробки 7. Только после этого вынимают кран 3 из аппарата, а за ним и воронку 2, высыпают остатки твердого вещества 5. Промыв тщательно аппарат водой, собирают его так, как было описано выше.
Кипп Петр Якоб (1808-1864) - голландский химик и аптекарь. Аппарат изобрел в 1853 г.
Если у аппарата Киппа воронка 2 разбита или по каким-либо причинам отсутствует, то для получения газа можно применить аппарат Верховского (рис. 229,б), напоминающий прибор Дебре и Сент-Клер-Девилля. Для предотвращения уноса капельно-жидкой фазы склянку 2 закрывают резиновой пробкой с каплеуловителем Ульша-Геккеля (см. рис. 42,г). Преимущество аппарата Верховского по сравнению с аппаратом Киппа состоит в том, что в нем можно получить более значительное давление газа, кроме того он дешевле.
В двухпробирочном приборе (рис. 229,в) пробирка 2 имеет придонные отверстия 5, закрытые изнутри обрезками стеклянных трубок, пропускающих жидкий, но задерживающий твердый реагенты. Когда газ не нужен, то кран на трубке 1 закрывают, и
избыточное давление газа выдавливает жидкость через слой стеклянных трубок и тверстия 5 в кольцевое пространство между пробирками 2 и 4. Внутренняя пробирка опирается на пробку 6 из полиэтилена. Трубка 3 служит для сообщения прибора с атмосферой.
В U-образном приборе (рис. 229,г), предназначенном чаще всего для аналитических целей, твердый реагент 4 загружают в сосуд 3, открыв пробку 1, на небольшой пористый диск 5. Образующийся газ выпускают через трубку 2, снабженную краном.
В табл. 33 приведены некоторые газы, получаемые с использованием приборов и аппаратов, представленных на рис. 228 и 229, и перечислены твердые и жидкие реагенты.
Здесь необходимы некоторые комментарии. Мрамор (карбонат кальция СаСО3), используемый для получения диоксида углерода, из-за пористости непосредственно в приборы не загружают, так как в этом случае газ будет содержать примесь воздуха. Кусочки мрамора предварительно обрабатывают разбавленной хлороводородной кислотой (15%) и затем кипятят в чистой воде около 10-15 мин. После этого их помещают
на дно вакуум-эксикатора (см. разд. 2.3), заливают водным раствором СаСl2 и откачивают водоструйным насосом (см. разд. 10.8) до прекращения выделения пузырьков воздуха.
Таблица 33. Газы, наиболее часто получаете в приборах с подводом жидкости снизу
Газ |
Твердый реагент; размер частиц, мм |
Жидкий реагент |
Примечания |
H2 |
Zn; гранулы, 5-6
А1; проволока |
НС1 (20%) или H2SO4 (15%)
КОН (20%) |
Добавляют водный раствор CuSO4. Примеси AsH3, РН3, O2, H2S, HCl, N2 В приборах заедает шлифы |
CO2 |
Кусочки мрамора; 20-30 |
НС1 (20%) |
Примеси N2, О2, H2S и НС1 |
H2S |
FeS; 5x15 CaS; 10 - 15 |
НС1(15%) НС1 (10%) |
Примеси О2, СО2 и H2 (до 12%) Без примеси H2 |
С12 |
Хлорная известь (35%);кубики 15x15 MnO2; 5-10 КМnO4; крупные кристаллы |
НС1 (20%) НС1 (36%) НС1 (36%) |
Примеси О2, СО2, N2, НС1 Без примеси О2 Примеси О2 (0,5%), СО2 |
О2 |
MnO2; 5-7
Хлорная известь (35%); кубики 15x15 |
1 л Н2O2 (3%) + + 150 мл H2SO4 (96%) I л Н2O2 (3%) + + 150 мл НС1 (36%) |
Примеси СО2, Cl2, SO2
Примеси СО2, НCl, SO2 |
NO |
Cu; стружки, проволока NaNO2; плавленный 5x15 |
HNO3, (25%)
H2SO4 (48%) |
Примеси О2, NO2
Примеси О2, NO2, N2O3 |
H2C2 |
СаС2; 10-15 |
H2O |
Примеси РН3 |
Кубики из хлорной извести для получения хлора или кислорода готовят смешиванием 100 г ее с 25 г гипса и небольшим количеством воды до кашеобразного состояния. Затем кашицей заполняют формы размером 15x15 мм. Бромоводородную и иодоводородную кислоты получают в небольших количествах в приборах, представленных на рис. 229,(в,г). Если нужен HBr, то в сосуд 3 (рис. 229,г) или в пробирку 2 (рис. 229,в) загружают кусочки белого фосфора. Жидким реагентом является бромная вода. Когда необходимы небольшие количества иодоводородной кислоты, то те же сосуды заполняют асбестовой или стеклянной ватой, смешанной с Р4O10. Жидким реагентом в этом случае служит 60%-я иодоводородная кислота.
Приборы капельного действия имеют капиллярные трубки 3 (рис. 230), через которые жидкий реагент поступает по каплям к твердому реагенту 10, находящемуся в реакционном сосуде 5. Все сосуды капельных аппаратов являются склянками Салюцо-Вульфа (см. рис. 29), но можно использовать и обычные колбы с резиновыми пробками, через которые пропущены стеклянные трубки.
Образующийся газ выпускают через кран 4, трубку которого соединяют при помощи резинового шланга с прибором - потребителем газа. Когда газ не нужен, кран 4 закрывают, и избыток газа либо начинает вытеснять жидкий реагент через слой стекловаты 7 в сосуд 6 (рис. 230,в,г), либо попадает до прекращения реакции через капилляр 3 в буферный сосуд 6 (рис. 230,а,б).
Отличительной особенностью капельных аппаратов является полное использование жидкого реагента. Он не смешивается после прекращения реакции со свежими порциями, так как его удаляют через кран 8 (рис. 230,а,б) или сбрасывают в аппаратах Парсонса и Хониша через сифон 9 (рис. 230, в,г).
Аппараты Оствальда и Мак-Кея. Недостаток аппаратов Оствальда (рис. 230,а), изобретенного в 1892 г., и Мак-Кея (рис. 230,б), предложенного в 1907 г., состоит в том, что после закрывания крана 4 реакция получения газа будет продолжаться до тех пор, пока жидкий реагент, оставшийся в твердом веществе 10, полностью не израсходуется. Правда, это случается только тогда, когда скорость потока жидкости через капилляр больше скорости реакции. Другой недостаток аппаратов Оствальда и Мак-Кея - необходимость тщательного выбора диаметра капилляра 3. Газ, находящийся в реакционном сосуде 5 под избыточным давлением, может через сравнительно большой диаметр капилляра прорваться в буферный сосуд 6 (рис. 230,а,б) и перекрыть поток жидкого реагента.
В аппарате Хониша (рис. 230,г) образование газа происходит в замкнутой системе, что позволяет создавать при помощи трех кранов 4, 11 к 12 большое дополнительное давление в сосуде 5 регулировать скорость выделения газа и удалять воздух из жидкого реагента, залитого в сосуд 1. Последнюю операцию выполняют, закрыв краны 4 и 11 и открыв кран 12. Образующийся в сосуде 5 газ через капилляр 3 и нижний тубус склянки 1 проходит через жидкость. Газ получают в приборе Хониша (рис. 230,г) при открытых кранах 4 и 11 и закрытом кране 12. Во всех рассмотренных аппаратах загрузку свежей порции твердого реагента 10 осуществляют через тубус 2.
К такому же типу аппаратов, т. е. с подачей жидкости сверху к твердому реагенту, принадлежат и простые установки, приведенные на рис. 231. Для ускорения реакции в них предусмотрено применение колбонагревателей 5 (см. разд. 6.5). Реакция жидкости с твердым реагентом 4 в колбе 2 прекращается при закрытом кране делительной воронки 1 (см. разд. 2.6). К газоотводной трубке присоединяют различные предохранительные приспособления 3 и поглотительные склянки (см. разд. 2.2) для чистки газов от тех или иных примесей (см. разд. 10.3). Если сопротивление потоку газа в системе очистки будет большим, то возможен выброс газа через делительную воронку. При прорыве газа следует перекрыть кран воронки 1 и уменьшить нагрев колбы. В крайнем случае в верхнее отверстие делительной воронки вставляют пробку со стеклянной трубкой, присоединении
через резиновый шланг к газометру (см. разд. 10.10), наполненному воздухом. Регулируя выпуск воздуха из газометра в делительную воронку, можно создать необходимое избыточное давление на жидкость и прекратить проскок газа через нее.
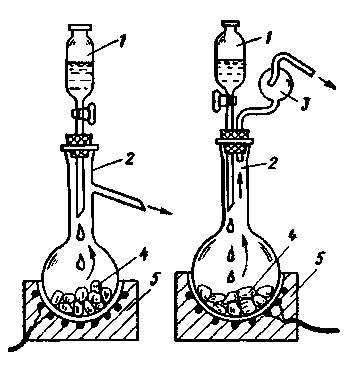
Рис. 231. Капельные аппараты с подогревом
Приборы для смешивания двух жидких реагентов (рис. 232).
Эти приборы, в отличие от рассмотренных выше, дают более равномерный поток образующегося газа и способствуют меньшему перегреву жидкости в реакционной колбе.
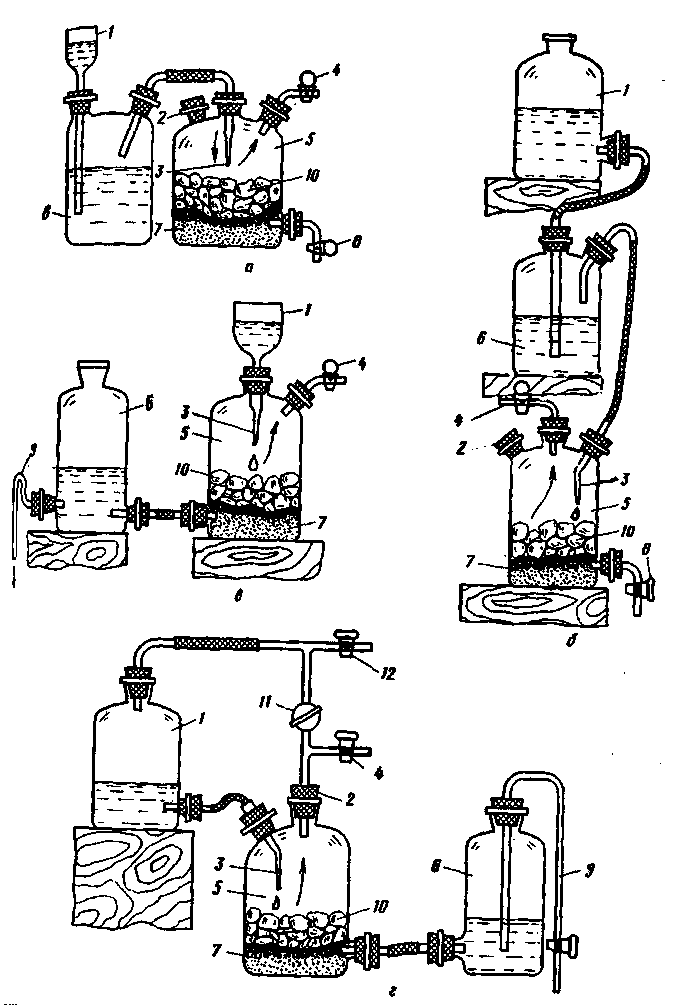
В приборе Гейлза (рис. 232,а) верхняя более тяжелая жидкость из воронки 1 стекает в виде тонкой пленки через отверстия 4 по наружным стенкам пробирки 5 к жидкости в сосуде 3 и реагирует с ней с выделением газа. Когда кран 2 закрыт, избыточное давление газа, поступающего через отверстия 4 в пробирку 5, вытесняет жидкость в воронку 1 до прекращения реакции.
Гейлз Стивен (1677-1761) - изобретатель приборов для получения и сбора газов.
Пробирка 5 составляет с воронкой 1 одно целое и связана с сосудом 3 либо пришлифованными поверхностями, либо резиновой пробкой.
В приборе Зайделя (рис. 232,б) обе жидкости одновременно стекают из делительных воронок 1 в сосуд 2, наполненный стеклянной ватой или обрезками небольших стеклянных трубок 3. На поверхности ваты или трубок жидкости смешиваются и вступают в реакцию с выделением газа. Прибор удобен тем, что в нем можно регулировать расход жидкостей. Иногда под нижние концы трубок делительных воронок укрепляют обычную маленькую воронку, в которой начинается смешивание жидкостей.
Прибор Зайделя позволяет, например, получать до 60 л/ч хлороводорода из равных объемов концентрированной серной и хлороводородной кислот, причем температура в сосуде 2 существенно не повышается.
Если необходимо, чтобы жидкости не сообщались с атмосферой, применяют видоизмененный аппарат Киппа (рис. 232,в). Этот аппарат позволяет получать газ, не содержащий примесей, присутствующих в воздухе. Прежде чем открыть кран 3, в аппарате создают вакуум, присоединяя трубку с краном 2 к водоструйному насосу. Вакуумирование сосудов 1 и 4 позволяет удалить и растворенные в жидкостях газы.
Небольшое количество газа получают при помощи более простого прибора (рис. 232,г), в котором для равномерного смешивания жидкостей и создания избыточного сопротивления на пути жидкости из воронки 1 конец ее трубки погружают в короткую пробирку 4. Тогда жидкость выливается из воронки 1 при постоянном давлении в сосуд 3 с отводной трубкой 2. Это простое приспособление напоминает пробирку 5 прибора Гейлза (см. рис. 232,а).
Для получения газа сливанием двух жидкостей пригодны аппараты Оствальда (см. рис. 230,а) и Мак-Кея (см. рис. 230,б), в которых вместо твердого вещества в сосуд 5 наливают одну из жидкостей. Поступление второй жидкости регулируют краном 4 газовой камеры.
Во всех приборах, используемых для получения газов, стараются сделать мертвое пространство, не омываемое газом, минимальным. Поэтому трубки, отводящие газ, располагают в самой верхней части прибора.
В табл. 34 приведены примеры получения газов путем смешивания двух жидкостей-реагентов.
Таблица 34. Газы, получаемые смешиванием двух жидких реагентов
Газ |
Жидкий реагент реакционного сосуда |
Добавляемый жидкий реагент |
Примечания |
N2 |
Водный раствор NH4CI |
Водный раствор |
Примеси NO2, NO, |
|
(27%) или (NH4)2SO4 |
NaNO2 (40%) |
N2O. Добавляют |
|
(42%) |
|
нагретый раствор |
O2 |
Концентрированный |
Н2O2 (15%) |
Примеси СО2, SO2, |
|
раствор КMnО4 в H2SO4 |
|
N2 |
|
(30%) |
|
|
СО2 |
Водный раствор KHCO3 |
H2SO4 (50%) |
Примеси SO2, H2SO4 |
|
(24%) |
|
|
СО |
H2SO4 (96%) |
НСООН (85%) |
Добавляют нагретую |
|
|
|
НСООН |
H2S |
Водный 35%-й раствор |
Водный раствор |
Добавляют нагретый |
|
MgCl2 |
(20%) NaHS |
реагент |
SO2 |
Водный 21%-й раствор |
H2SO4 (50%) |
Примеси СО2, O2, H2S |
|
Na2SO3 |
|
|
NO |
Водный раствор FeCl2 |
Водный раствор |
Примеси O2, NO2, HCl |
|
(30%) или FeSO4 (20%) + |
(40%) NaNO2 |
|
|
+ равный объем НСl (36%) |
|
|
|
В 1 л Н,0 300 г KN02 и |
H2SO4 (50%) |
- |
|
150 г KI |
|
|
HCl |
HCl (36%) |
H2SO4 (96%) |
Примеси Cl2, H2SO4, H2S |
|
SiCl4 |
H2O |
Аэрозоль SO2 |
HBr |
С6Н6 или С10Н12 (тетралин) |
Br2 |
К C6H6 добавляют |
|
|
|
5 - 6 г FeBr3 |
Для получения больших количеств хлороводорода применяют прибор колонного типа (рис. 233,а). В склянку 5 наливают концентрированную хлороводородную кислоту. Затем устанавливают колонку 4, наполненную обрезками небольших стеклянных трубок или кольцами Рашига (см. разд. 8.4). Капельную воронку 1 заполняют концентрированной серной кислотой, а трубку с краном 3 присоединяют к приемнику газа. После сборки установки открывают кран 2 и медленно, по каплям, подают в колонку серную кислоту, которая, пройдя колонку, попадает в склянку 5 и вызывает выделение хлороводорода. Хлороводород поднимается по колонке навстречу потоку H2SO4, высушивающему его,
и выходит через трубку с краном 3. Кран 6 служит для периодического слива из прибора отработанной жидкости.
Чтобы получить сухой бромоводород, в колбу Клайзена 6 (рис. 233,б) наливают бензол или тетралин (1,2,3,4-тетрагидронафталин, С10Н12). Колбу нагревают в колбонагревателе 7 (см. разд. 6.5) и к кипящей жидкости прибавляют из капельной воронки 4 бром, используя кран 5. Образующийся НВr поднимается по колонке 2, наполненной небольшими обрезками стеклянных трубок. В колонке конденсируется пар С6Н6 или С10Н12, конденсат стекает в колбу 6, а НВr через трубку 1 удаляется из прибора. Колонка соединена с капельной воронкой трубкой 3, уравновешивающей давление, что позволяет осуществлять непрерывную подачу брома.
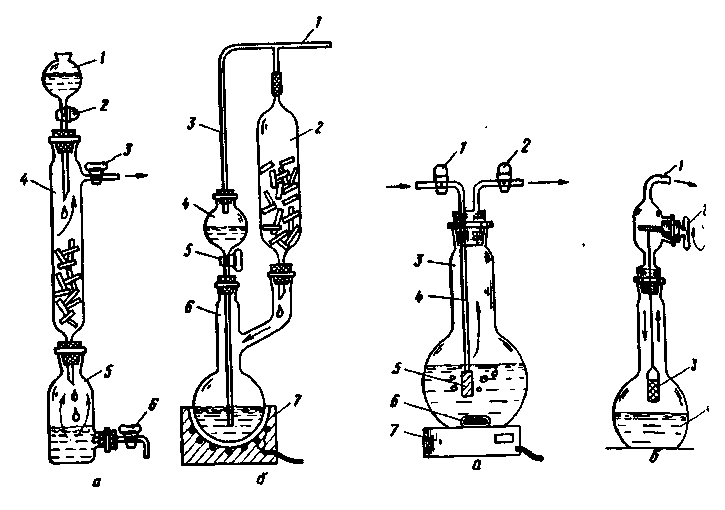
Рис. 234. Приборы для получения газов воздействием газа-реагента (а) или катализатора (б) на жидкость
Для получения газа методом взаимодействия жидкого реагента с другим газом или катализатором применяют приборы, приведенные на рис. 234. В приборе с пористым патроном 5 (Рис. 234,а) через жидкость-реагент, перемешиваемый магнитной мешалкой 6-7(см. разд. 9.2) пропускают газ по трубке 4, регулируя его поток краном 1. Пористый патрон дробит струю газа на мельчайшие пузырьки, взаимодействующие с жидкостью-
реагентом. Образующийся новый газ в смеси с исходным удаляется из колбы 3 через трубку с краном 2.
В таком приборе можно получить, например, азот при пропускании аммиака через бромную воду:
8NH3 + 3Br2 = N2 + 6NH4Br.
Используют этот прибор и для получения нитрозилхлорида NOCl путем взаимодействия хлороводорода со смесью (NO)HSO4 и H2SO4:
(NO)HSO4 + HCl = NOCl + H2SO4.
Если заменить стекло на полиэтилен или фторопласт-4, можно получить дифторид кислорода с выходом около 45% при пропускании фтора в 2%-й водный раствор гидроксида натрия:
2F2 + 2NaOH = OF2 + 2NaF + H2O.
Некоторые газы можно синтезировать воздействием твердых катализаторов на жидкость-реагент. Например, для получения чистейшего O2, свободного от примеси азота, прибегают к каталитическому разложению 30%-го пероксида водорода в платинированной никелевой трубке или зерен MnO2, загруженных в перфорированный стеклянный стаканчик 3 (рис. 234,б). Чтобы прекратить поток кислорода через трубку 1 катализатор (Ni или MnO2) извлекают из водного раствора пероксида водорода. Разложение последнего протекает в соответствии с реакцией
2Н2O2 = O2 + 2Н2O.
Приборы для термического разложения твердого вещества представлены на рис. 235. Выделение газа происходит при нагревании веществ в ретортах (рис. 235,а), круглодонных колбах из термостойкого стекла (рис. 235,б), в длинных пробирках (рис. 235,в), в уткообразных сосудах (рис. 235,г) или лодочках (рис. 235,д). Конструкции и способы применения всех этих приборов не требуют особых пояснений.
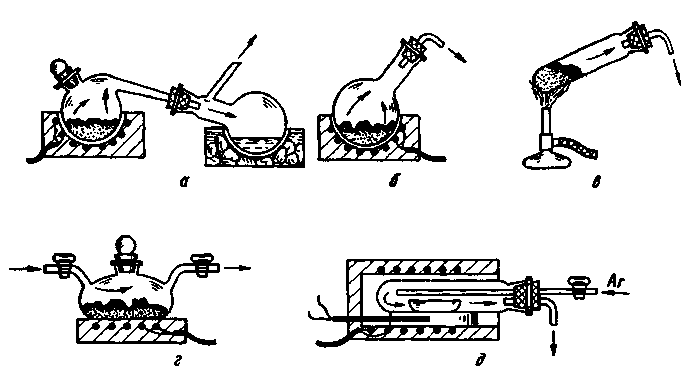
Рис. 235. Приборы для получения газов методом нагревания твердых веществ в реторте (а), колбе (б), пробирке (в), уткообразном сосуде (г) и в лодочке (д)
Характеристика приведенных на рис. 235 сосудов дана в разд. 2.1, 2.2 и 2.8. При получении газа приборы связывают через систему предохранительных и поглотительных склянок (см. разд. 2.3) с сосудами для хранения (рис. 269 - 272) или непосредственного использования выделяющегося газа. В рассматриваемом процессе на стенках сосудов может конденсироваться вода, присутствующая почти всегда в виде примеси в твердых веществах. При стекании ее на нагретую поверхность можетпроизойти растрескивание сосуда. Поэтому такие сосуды предпочитают изготавливать из кварца (см. разд. 1.1) и близких к нему по термостойкости материалов. Если применяют обычное термостойкое стекло, то на горло колб наносят теплоизоляцию
(см. разд. 6.12) или надевают разъемный трубчатый электронагреватель (см. разд. 6.5).
Перед нагреванием для удаления большей части воздуха сосуд вакуумируют при помощи водоструйного насоса. Приборы типов г и д (рис. 235) применяют для термического разложения веществ в восстановительной или инертной атмосфере при пропускании над веществом соответственно водорода или аргона (азота).
Для достижения полного разложения твердого вещества температуру по мере протекания реакции необходимо повышать постепенно. Быстрый рост температуры может вызвать спекание твердой фазы и увеличение сопротивления выходу газа. Нежелательно также допускать плавление вещества перед разложением.
