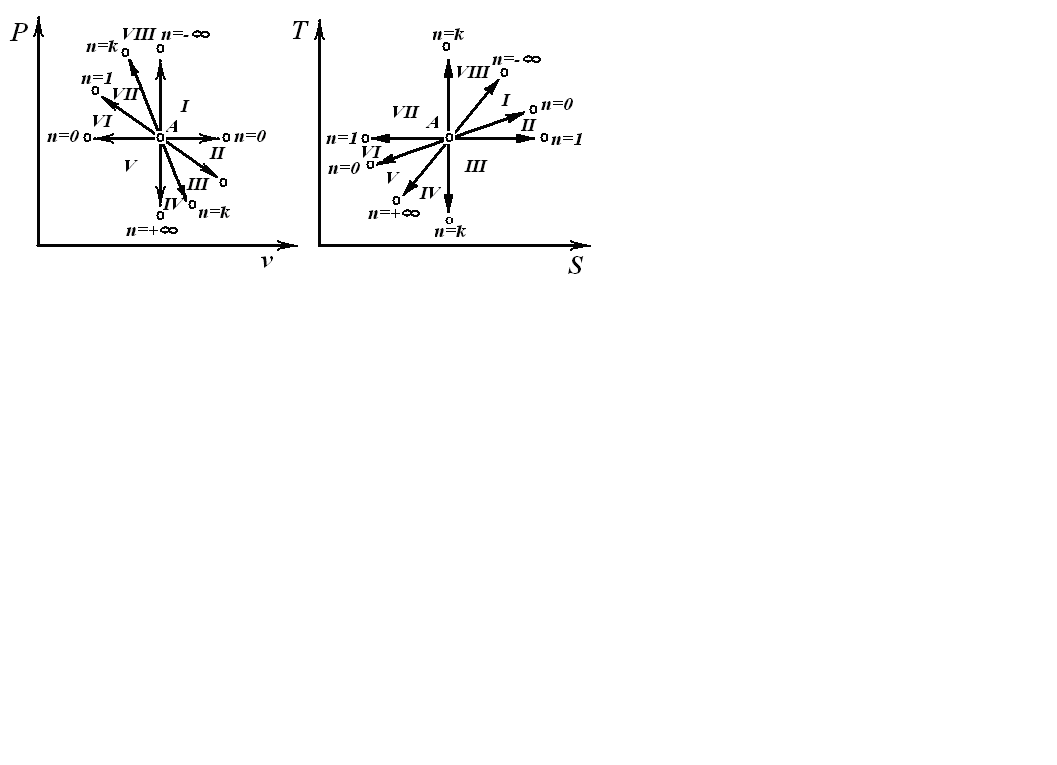- •І. Технічна термодинаміка
- •Основні поняття й визначення технічної термодинаміки
- •1.1. Технічна термодинаміка та її методи
- •1.2. Теплота і робота. Термодинамічна система. Робоче тіло
- •1.3. Параметри стану. Рівняння стану
- •1.4. Термодинамічні процеси
- •Газові суміші
- •2.Перший і другий закони термодинаміки
- •2.1. Формулювання й аналітичне вираження першого закону
- •Вираження теплоти і роботи через параметри стану
- •2.3. Теплоємність
- •2.4. Формулювання і аналітичне вираження другого закону термодинаміки
- •2.5. Прямі і зворотні цикли теплових двигунів
- •2.6. Цикл Карно
- •3. Термодинамічні процеси ідеальних газів
- •3.1. Ізохорний процес
- •3.2. Ізобарний процес
- •3.3. Ізотермічний процес
- •3.4. Адіабатний процес
- •3.5. Політропний процес
- •4. Термодинамічні процеси в реальних газах і парі
- •4.1. Властивості реальних газів
- •Фазові переходи
- •4.3 Пари, основні визначення
- •4.4 Процес паротворення в p-υ і t-s координатах
- •4.5 Параметри рідини і пари
- •5. Вологе повітря
- •6. Витікання та дроселювання газів і пари
- •7. Термодинамічні процеси в компресорах
- •8. Цикли двз (двигунів внутрішнього згоряння)
- •9. Цикли гту (газотурбінних установок)
- •10. Цикли псу (паросилових установок)
- •11. Холодильні установки
- •II. Теория теплообміну
- •12. Теплопровідність
- •12.1. Види теплообміну. Основні положення теплопровідності
- •12.2. Закон Фур'є
- •12.3. Диференціальне рівняння теплопровідності
- •12.4. Теплопровідність через стінку при стаціонарному режимі
- •12.5. Теплопровідність при нестаціонарному режимі
- •13. Конвективный теплообмін (кт)
- •13.1. Основні поняття й визначення
- •13.2. Фізичний зміст критеріїв подібності
- •13.3. Основні види кт
- •13.4. Теплообмін при кипінні
- •13.5. Теплообмін при конденсації
- •14. Теплопередача
- •14.1. Процес теплопередачі
- •14.2. Теплопередача через плоску стінку при стаціонарному режимі
- •14.3. Теплопередача через циліндричну стінку при стаціонарному режимі
- •14.4. Критичний діаметр теплової ізоляції
- •14.5. Інтенсифікація теплопередачі
- •15. Теплообмін випромінюванням
- •15.1. Основні поняття й визначення
- •15.2. Закони випромінювання
- •15.3. Теплообмін випромінюванням у прозорому середовищі
- •15.4. Складний теплообмін
- •15.5. Випромінювання газів
- •16. Теплообмінні апарати
- •16.1. Класифікація апаратів
- •16.2. Схеми руху теплоносіїв
- •16.3. Середній температурний напір
- •16.4. Теплові розрахунки теплообмінних апаратів
- •16.5. Основи гідромеханічного розрахунку теплообмінних апаратів
- •17. Паливо і основи горіння
- •17.1. Види палива
- •17.2. Елементарний склад палива
- •17.3. Фізичний процес горіння палива
- •17.4. Топковий пристрій
- •17.5. Основні формули процесу горіння
- •18. Теплопостачання. Сушильні установки
- •18.1. Теплопостачання
- •18.1. Сушильні установки
- •19. Котельні установки
- •20. Відновлювані джерела енергії (вдр)
- •Література
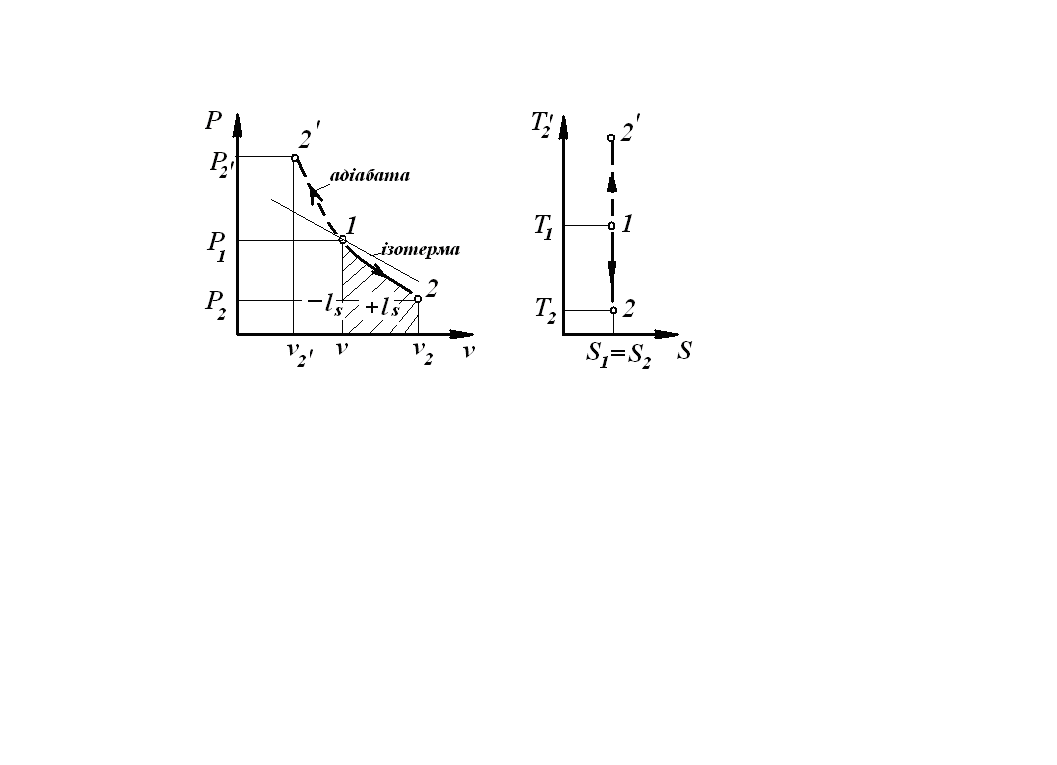
3.4. Адіабатний процес
Адіабатним
(ізоентропним) називається процес, який
протікає без теплообміну з навколишнім
середовищем, з постійною ентропією
S=const. У P-V координатах адіабата
являє собою нерівнобічну гіперболу,
показник адіабати
![]() .
.
Процеси: 1-2 – розширення, - стиснення. |
2. ls=Δu;
|

3. qs=0.
6.
![]() .
.
7. Схема енергобалансу: робота здійснюється за рахунок зменшення внутрішньої енергії.
3.5. Політропний процес
Політропним
називається процес, який протікає з
постійною теплоємністю
![]() =const
і підкоряється рівнянню Pvn=const,
де n-показник політропи.
=const
і підкоряється рівнянню Pvn=const,
де n-показник політропи.
|
|
Області: I÷IV – розширення робочого тіла, позитивна робота; V÷VIII – стиск робочого тіла, негативна робота; I÷III,VIII – підведення теплоти; IV÷VIII – відведення теплоти; VII, VIII, I, II – підвищення температури тіла; III, IV, V, VI – зниження температури тіла. |
|
|
|
В залежності від величини n поле діаграми P-v і T-S ділиться на вісім частин. Усі процеси починаються в точці А. |
|
4. Термодинамічні процеси в реальних газах і парі
4.1. Властивості реальних газів
Реальним
газом
(РГ) називається газ, між молекулами
якого існують сили тяжіння і відштовхування,
а молекули й атоми цього газу мають масу
і об'єм. При високому тиску Р
і низьких температурах T
властивості
РГ відхиляються від властивостей
ідеальних
газів
(ІГ). Істотною відмінністю є те, що РГ
може перебувати в газоподібному, рідкому
і твердому стані. Згідно правил фаз
Гіббса для чистої речовини в однофазному
стані незалежно можуть змінюватися два
параметри (наприклад Р
і T),
в двофазному стані – тільки один
(наприклад, або T,
або Р),
в трифазному стані три фази можуть
знаходиться в рівновазі при цілком
визначених Р
і T.
Відмінність властивостей РГ від ІГ
визначається по коефіцієнту стисливості
![]() .
.
Для
ідеального газу Z=1,
для реального
![]() .
.
Рівняння стану Ван-дер-Ваальса:
![]()
а, b – постійні коефіцієнти, які залежать від природи газу;
v – власний об'єм молекул;
![]() -
внутрішній тиск.
-
внутрішній тиск.
Приведене рівняння Ван-дер-Ваальса:
![]()
![]() .
.
Фазові переходи
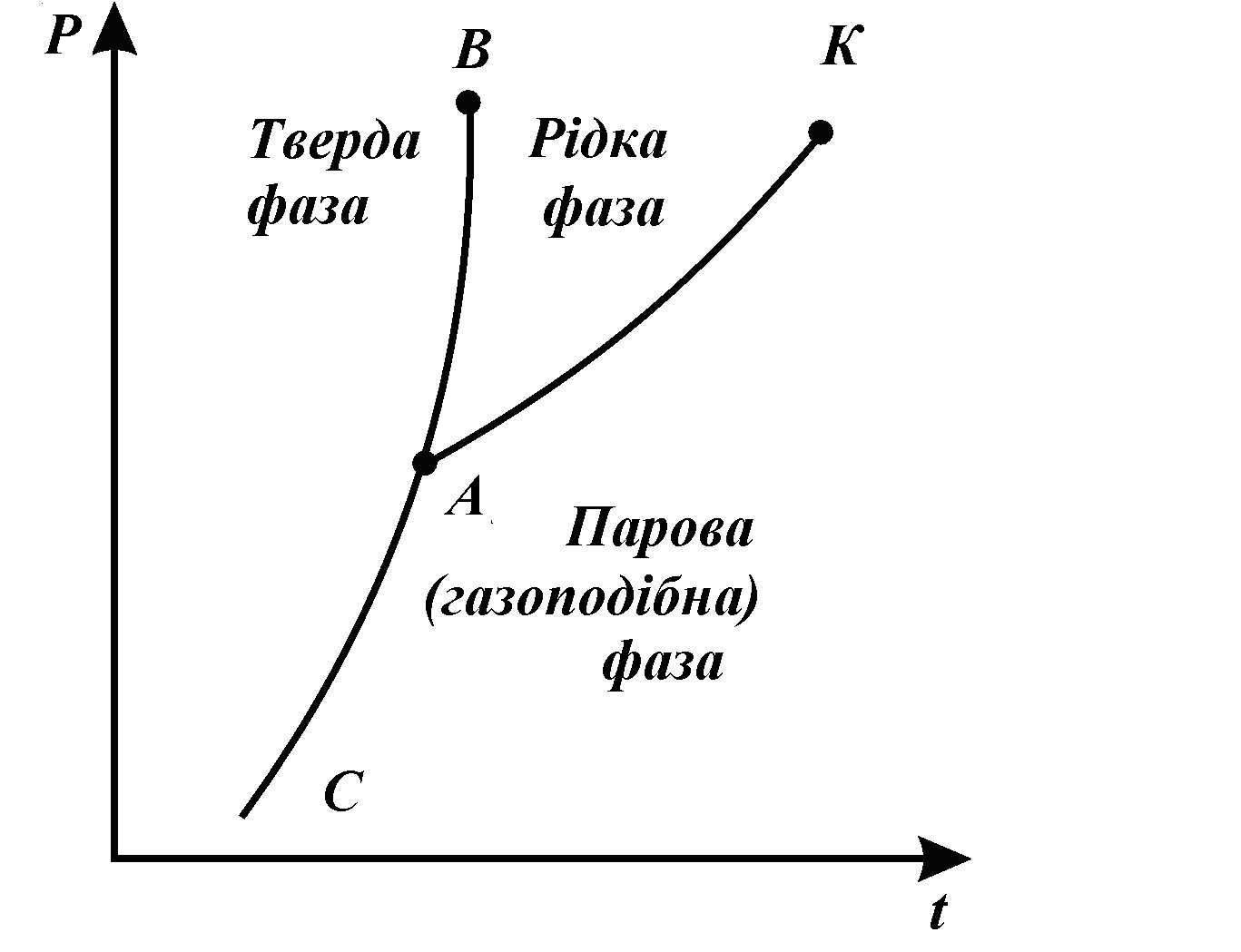
Рівноважне співіснування декількох, дотичних між собою фаз речовин, які переходять одна в одну, називається фазовою рівновагою. Перехід речовини з однієї фази в іншу називається фазовим переходом. Перехід з твердої фази в рідку – плавлення. Перехід з рідкої фази в пароподібну: випаровування – пароутворення з поверхні рідини, кипіння – бурхливе пароутворення в об'ємі з паровими міхурами. Перехід з пароподібного стану в рідкий – конденсація. Перехід з твердої фази у пароподібну – сублімація. Криві фазових переходів зображаються в P-t діаграмі.
|
Рівноважні криві: АВ – плавлення; АК – пароутворення; АС – сублімація. Точка, у якій речовина існує в трьох агрегатних станах, називається потрійною точкою (т.А). Лінія пароутворення закінчується критичною точкою К. Її параметри. У цій точці:
Ніяким зусиллям стиснення неможливо сконденсувати пару. |
Теплота,
що витрачається на перехід 1 кг речовини
з
одного агрегатного стану в інший
називається теплотою фазового переходу.
Вона витрачається на руйнування
кристалічних грат, на розрив зв'язку
між молекулами. Розрізняють теплоту
плавлення, сублімації і паротворення
(![]() ).
).