
- •Введение Общие рекомендации для подготовки к лабораторным занятиям
- •Лабораторная работа №_____ Тема:________________________________________________
- •Классификация неорганических веществ по составу
- •Неметалл
- •Классификация бинарных соединений
- •Классификация оксидов по составу
- •1.2.2. Трехэлементные соединения с кислородом и водородом (гидроксисоединения)
- •Классификация гидроксисоединений и их производных – солей
- •Список традиционных названий оксокислот и солей Таблица 4
- •2.Классификация веществ по типу химической связи и физическим свойствам
- •Классификация кристаллов по типу химической связи
- •Диссоциация воды. Водородный и гидроксильный показатели
- •5. Классификация неорганических веществ по кислотно-основным свойствам
- •5.1. По кислотно-основным свойствам неорганические соединения подразделяют:
- •Основание
- •Кислота
- •Амфотерное соединение
- •Кислота Основание Основание Кислота
- •5.2. Взаимодействие оксидов и гидроксисоединений с водой
- •5.3. Реакция нейтрализации
- •Например:
- •5.3.4. Закономерности изменения кислотно-основных свойств оксидов
- •Сравнительная характеристика свойств оксидов металлов и неметаллов
- •Генетическая связь между классами неорганических соединений
- •5.4. Гидролиз солей
- •Факторы, влияющие на гидролиз соли
- •6.Основные способы получения оксидов и гидроксидов
- •6.1. Способы получения оксидов
- •6.2. Способы получения гидроксидов
- •7. Лабораторные работы по теме:
- •7.1. Лабораторная работа № 1.
- •Задание 1.4.23 Сумма коэффициентов в молекулярном уравнении реакции
- •7.2. Лабораторная работа № 2.
- •7.3. Лабораторная работа № 3
- •7.4. Лабораторная работа № 4
- •8. Окислительно-восстановительные процессы
- •Основные понятия
- •Направление протекания окислительно-восстановительных реакций
- •8.3. Химические свойства металлов
- •8.3.1. Ряд стандартных окислительно-восстановительных потенциалов металлов
- •8.3.2. Взаимодействие металлов с водой
- •8.3.3. Взаимодействие металлов с водными растворами щелочей
- •8.3.4. Взаимодействие металлов с растворами кислот, окисляющими
- •8.3.5. Взаимодействие металлов с концентрированной серной кислотой
- •8.3.6. Взаимодействие металлов с азотной кислотой
- •8.4. Лабораторная работа № 5
- •Электрохимические процессы
- •9.1. Основные понятия
- •Сравнение процессов в гальванических элементах и электролиза
- •9.2. Гальванический элемент
- •Электрохимическая коррозия
- •I процесс (коррозия с водородной деполяризацией)
- •II процесс (коррозия с кислородной деполяризацией)
- •9.4. Электролиз
- •Электролиз растворов солей
- •Электролиз водного раствора сульфата меди (II) с инертным анодом
- •Ряд разряжаемости катионов на катоде
- •Ряд разряжаемости анионов на аноде
- •9.5. Лабораторная работа № 6
- •Приложение
- •Константы диссоциации некоторых кислот
- •Произведение растворимости некоторых малорастворимых электролитов при 25оС
- •Стандартные окислительно-восстановительные потенциалы
- •Библиографический список
- •Содержание
Направление протекания окислительно-восстановительных реакций
Условием протекания окислительно-восстановительных реакций является наличие двух сопряженных окислительно-восстановительных пар, причем взаимодействие осуществляется между сильным окислителем и сильным восстановителем с образованием слабого окислителя и слабого восстановителя:

 окислитель (1) +
восстановитель (2) → восстановитель
(1) + окислитель (2)
окислитель (1) +
восстановитель (2) → восстановитель
(1) + окислитель (2)
 сильные
слабые
сильные
слабые
Свойства сопряженной окислительно-восстановительной пары характеризует окислительно-восстановительный потенциал (φок./вос.).
Чем больше величина окислительно-восстановительного потенциала, тем более сильным окислителем является окисленная форма системы и тем слабее выражены восстановительные свойства восстановленной формы.
Чем меньше величина окислительно-восстановительного потенциала, тем более сильным восстановителем является восстановленная форма системы.
В самопроизвольных окислительно-восстановительных реакциях окислитель имеет больший (более положительный), а восстановитель – меньший (менее положительный) окислительно-восстановительный потенциал.
φок(1) > φвос(2)
Следовательно, разность окислительно-восстановительных потенциалов - электродвижущая сила (ЭДС) – самопроизвольно протекающих окислительно-восстановительных реакций положительна.
ЭДС = φок(1) – φвос(2) > 0
Определить абсолютное значение окислительно-восстановительного потенциала сопряженной окислительно-восстановительной пары нельзя. Но можно измерить разность потенциалов между двумя окислительно-восстанови-тельными системами (рис. 5)
За систему сравнения выбран стандартный водородный электрод: платиновая пластина, погружённая в раствор кислоты с концентрацией ионов
[Н+]=1 моль/л, которая при 101,325 кПа и 298 К омывается водородом.
Стандартный окислительно-восстановительный потенциал для системы Н2 2Н+ + 2е–,
возникающий в стандартном водородном электроде, принят равным нулю: φо(Н+/Н2) = 0,00 В.
О
Вольтметр
б)
а)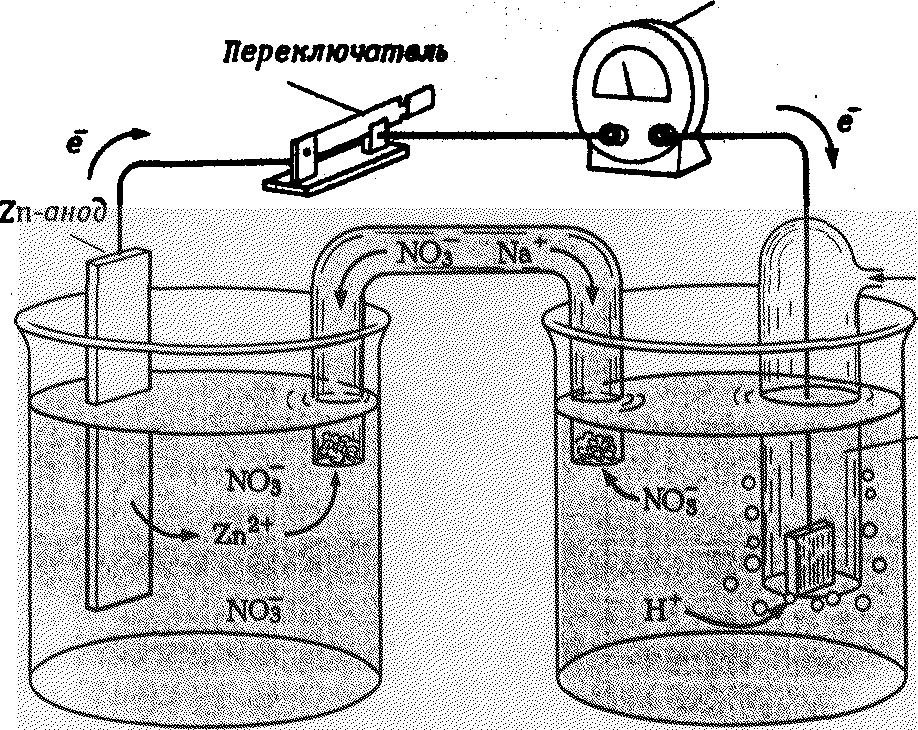
Рис. 5. Гальванический элемент с водородным электродом:
а) цинковый электрод; б) водородный электрод
8.3. Химические свойства металлов
8.3.1. Ряд стандартных окислительно-восстановительных потенциалов металлов
Металлы
в реакциях с любыми простыми или сложными
веществами проявляют восстановительные
свойства. Химическую активность металлов
в реакциях с водными растворами
окислителей характеризует
окислительно-восстановительный
потенциал
![]() .
Ряд
стандартных окислительно-восстановительных
потенциалов металлов (ряд напряжений
металлов, ряд стандартных электродных
потенциалов металлов) – последовательность,
в которой металлы расположены в порядке
увеличения стандартных
окислительно-восстановительных
потенциалов для систем
.
Ряд
стандартных окислительно-восстановительных
потенциалов металлов (ряд напряжений
металлов, ряд стандартных электродных
потенциалов металлов) – последовательность,
в которой металлы расположены в порядке
увеличения стандартных
окислительно-восстановительных
потенциалов для систем
Ме – ne Men+
восст. форма окисл. Форма
|
Восстановительная способность металлов увеличивается
|
|||||
|
неблагородные металлы |
|
|
|
|
благородные металлы |
|
Li K Ca Na Mg Al Mn Zn Cr Fe Cd Ni Pb Н2 Cu Ag Hg Au |
|||||
|
Li+ K+ Ca2+ Na+ Mg2+ Al3+ Mn2+ Zn2+ Cr3+ Fe2+ Cd2+ Ni2+ Pb2+ Н+ Cu2+ Ag+ Hg2+ Au3+ |
|||||
|
- |
|||||
|
Окислительная способность катионов металлов увеличивается |
|||||
|
Стандартный электродный потенциал пары металл/катион металла увеличивается |
|||||
Анализ ряда стандартных окислительно-восстановительных потенциалов металлов
Чем левее металл в ряду, тем он химически активнее, легче окисляется и труднее восстанавливается из ионов.
Чем правее стоит металл в ряду, тем меньше его восстановительная способность и тем более выражена окислительная способность катионов металла.
Каждый металл, не разлагающий воду, вытесняет все последующие, правее стоящие металлы, из растворов их солей.
Например
2е


![]() →
→
![]() ;
;
![]() <
<
![]() =
-0,14
=
-0,14
Металлы, стоящие в ряду левее водорода, характеризуются отрицательными значениями окислительно-восстановительных потенциалов и вытесняют молекулярный водород из растворов кислот (HCl, CH3COOH, RCOOH, H2SO4(разб.)…)
2Мео + 2nH+ → 2Men+ + nH2
восстановитель окислитель
![]() <
<
![]()
Например:
Fe + 2HCl → FeCl2 + H2
= -0,44 <
Металлы, стоящие в ряду правее водорода, характеризуются положительными значениями окислительно-восстановительных потенциалов и не вытесняют молекулярный водород из растворов кислот.
Например:
Cu + HCl
![]()
![]() >
>
![]()


 3,04
-2,92 -2,87 -2,71 -2,36 -1,66 -1,18 -0,76
-0,74 -0,41 -0,40 -0,25 -0,13 0 +0,34
+0,80 +0,85 +1,41
3,04
-2,92 -2,87 -2,71 -2,36 -1,66 -1,18 -0,76
-0,74 -0,41 -0,40 -0,25 -0,13 0 +0,34
+0,80 +0,85 +1,41