
- •3. Две физические реальности......
- •4. Структурные уровни организации материи
- •5) Фундаментальные понятия в механической картине мира
- •Первый закон Кеплера (закон эллипсов)
- •Второй закон Кеплера (закон площадей)
- •Третий закон Кеплера (гармонический закон)
- •8) Механический детерминизм. Причинность
- •10) Статистические и динамические закономерности
- •13) Вероятностная трактовка энтропии
- •14) Принципы дальнодействия и близкодействия с электромагнетизме
- •15) Назовите основные постулаты сто
- •Принцип постоянства скорости света:
- •16. Основные следствия сто.
- •1 7. Назовите основные постулаты ото.
- •18. Что такое "Парадокс близнецов"
- •19. Эмпирические доказательства ото
- •20. Волна как распространяющееся возмущение поля.
- •21. Что такое интерференция, дифракция, поляризация.
- •22.Корпускулярные свойства света
- •1. Фотоэффект
- •2. Эффект Комптона
- •23.Назовите важнейшие законы и открытия в области электричества и магнетизма, положенные в основу эмкм.
- •24. В чем состоит суть открытия Эрстеда?...
- •25. Охарактеризуйте вклад м.Фарадея в создание эмкм.
- •26. В чем заключается суть электронной теории Лоренца?
- •27. Опишите модель атома, предложенную Резерфордом.
- •29. Принцип неопределенности Гейзенбе́рга
- •31. Уравнение Шрёдингера
- •32) Фундаментальные физические воздействия
- •33) Понятие физического вакуума
- •35. Эволюция вселенной и реликтовое излучение
- •37) Что такое "Галактика"
- •40) От чего зависит эволюционный путь звезды?
- •41.В чем заключается концепции развития геосферных оболочек?
- •42.Сопоставьте и проанализируйте понятии биосферы и ноосферы?
- •43.Основные гипотезы происхождения жизни на Земле?
- •44.В чем особенности термодинамики энергетики живых систем?
- •45.Какие общие особенности планет Солнечной системы свидетельствуют о едином происхождении планет?
- •48. Что такое геохронология? На какие части (по степени изученности) подразделяется история Земли?
- •49.Какие элементы называются органогенами и почему? Какие элементы образуют химический состав живых систем?
- •50. Что такое самоорганизация
- •51. Что такое эволюционная химия? Что можно сказать о естественном отборе хим. Элементов и их соединений в ходе хим. Эволюции?
- •52. Что означает саморазвитие каталитических систем? теория Руденко.
- •53. Основные теории возникновения жизни
- •54. Чем отличается теория биохим. Эвол. От теории самопроизвол. Зарождения жизни? Какие условия считаются необходимыми для возникновения жизни в рез-те биохим. Эвол?
- •55.Теория биохим эволюции. Абиогенный синтез
- •56. Теория Опарина-Холдейна
- •57. Гиперцикл. Зарождение жизни
- •58. Идеи эволюционной биологии на молекулярно-генетическом уровне.
- •3 Закон.
- •65. Наследственная изменчивость
- •Поток генов
- •78. Основные понятия и принципы синергетики. Открытость, нелинейность, диссипативность
- •79 Порядок и хаос. Бифуркации и параметры порядка.
- •80. Примеры самоорганизации в неживой природе. Самоорганизация в социальных системах
- •Самоорганизация в социальных системах
26. В чем заключается суть электронной теории Лоренца?
В первой половине 90-х годов Лоренц уже выступает в печати с общей теорией электромагнитных и оптических явлений, опирающейся, с одной стороны, на теорию Максвелла, а с другой стороны, на представление о существовании элементарных электрических зарядов, связанных с частицами вещества. Эта теория впоследствии (после открытия электрона) получила название электронной теории.
Заряженные частицы вещества, называемые Лоренцем ионами, вызывают в окружающей их среде, т. е. в эфире, особое состояние, которое определяется значениями напряженности электрического Е и магнитного Н полей. Заряженная частица должна испытывать действие силы, которая зависит от значений Е иН в точке ее нахождения, а также и от скорости ее движения. Эта сила получила название сила Лоренца.
Непосредственно применять уравнение Лоренца для описания электромагнитных процессов в макроскопических масштабах в случае наличия среды нельзя. Величины Е и Н изменяют свои значения уже на расстоянии атомных размеров и притом чрезвычайно быстро, так что доступные измерению значения электрических и магнитных полей представляют собой средние значения этих величин. Поэтому, чтобы иметь возможность применять уравнения Лоренца для макроскопических полей, их нужно усреднить. Для случая неподвижных сред, получаются обычные уравнения Максвелла. В случае, когда среда обладает магнитными свойствами, усреднение уравнений Лоренца более сложно, но и тогда для неподвижных сред приходим к уравнениям Максвелла. Для случая же, когда среда движется как целое, усреднение уравнений Лоренца приводит к новым уравнениям, их Лоренц считает уравнениями для движущихся сред.
Нужно отметить, что разработка Лоренцем электронной теории в значительной степени была обусловлена попыткой создать электродинамику движущихся сред. Этим и обусловлено название его главного труда «Опыт теории электрических и оптических явлений в движущихся телах».
27. Опишите модель атома, предложенную Резерфордом.
Рассеяние отдельных α-частиц на большие углы Резерфорд объяснил тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10-10м, как предполагали ранее, а сосредоточен в центральной части атома (атомном ядре) в области значительно меньших размеров. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию α-частиц нужно принять радиус атомного ядра равным примерно 10-15м.
Р езерфорд
предположил, что атом устроен подобно
планетарной системе. Как вокруг Солнца
на больших расстояниях от него обращаются
планеты, так электроны в атоме обращаются
вокруг атомного ядра. Радиус круговой
орбиты самого далекого от ядра электрона
и есть радиус атома. Такая модель атома
была названа планетарной моделью.
езерфорд
предположил, что атом устроен подобно
планетарной системе. Как вокруг Солнца
на больших расстояниях от него обращаются
планеты, так электроны в атоме обращаются
вокруг атомного ядра. Радиус круговой
орбиты самого далекого от ядра электрона
и есть радиус атома. Такая модель атома
была названа планетарной моделью.
Планетарная модель атома объясняет основные закономерности рассеяния заряженных частиц.
Так
как большая часть пространства в атоме
между атомным ядром и обращающимися
вокруг него электронами пуста, быстро
заряженные частицы могут почти свободно
п роникать
через довольно значительные слои
вещества, содержащие несколько тысяч
слоев атомов.
роникать
через довольно значительные слои
вещества, содержащие несколько тысяч
слоев атомов.
При столкновениях с отдельными электронами быстрые заряженные частицы испытывают рассеяние на очень большие углы, так как масса электрона мала. Однако в тех редких случаях, когда быстрая заряженная частица пролетает на очень близком расстоянии от одного из атомных ядер, под действием силы электрического поля атомного ядра может произойти рассеяние заряженной частицы на любой угол до 180°.
Бо́ровская
моде́ль а́тома
(Моде́ль Бо́ра) — полуклассическая
модель атома,
предложенная Нильсом
Бором в
1913 г. За основу он взял планетарную
модель атома, выдвинутую Резерфордом.
Однако, с точки зрения классической
электродинамики, электрон в модели
Резерфорда, двигаясь вокруг ядра, должен
был бы излучать непрерывно,
и очень быстро, потеряв энергию, упасть
на ядро. Чтобы преодолеть эту проблему
Бор ввел допущение, суть которого
заключается в том, что электроны в атоме
могут двигаться только по определенным
(стационарным) орбитам, находясь на
которых они не излучают, а излучение
или поглощение происходит только в
момент перехода с одной орбиты на другую.
Причем стационарными являются лишь те
орбиты, при движении по которым момент
количества движения электрона равен
целому числу постоянных
Планка[1]: ![]() .
.
Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты Rnи энергии En находящегося на этой орбите электрона:
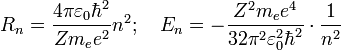
Здесь me — масса электрона, Z — количество протонов в ядре, ε0 — диэлектрическая постоянная, e — заряд электрона.
Именно такое выражение для энергии можно получить, применяя уравнение Шрёдингера, решая задачу о движении электрона в центральном кулоновском поле.
28. Во́лны де Бро́йля — волны, связанные с любыми микрочастицами и отражающие их волновую природу.
Для
частиц не очень высокой энергии,
движущихся со скоростью ![]() (скорости
света),
импульс равен
(скорости
света),
импульс равен ![]() (где
(где ![]() —
масса частицы), и
—
масса частицы), и ![]() .
Следовательно, длина волны де Бройля
тем меньше, чем больше масса частицы и
её скорость. Например, частице с массой
в 1 г, движущейся со скоростью 1 м/с,
соответствует волна де Бройля с
.
Следовательно, длина волны де Бройля
тем меньше, чем больше масса частицы и
её скорость. Например, частице с массой
в 1 г, движущейся со скоростью 1 м/с,
соответствует волна де Бройля с ![]() м,
что лежит за пределами доступной
наблюдению области. Поэтому волновые
свойства несущественны в механике
макроскопических тел. Для электронов
же с энергиями от 1 эВ до
10 000 эВ длина волны де Бройля лежит в
пределах от ~ 1 нм до 10−2 нм, то есть в
интервале длин волн рентгеновского
излучения.
Поэтому волновые свойства электронов
должны проявляться, например, при их
рассеянии на тех же кристаллах, на
которых наблюдается дифракция рентгеновских
лучей.[1]
м,
что лежит за пределами доступной
наблюдению области. Поэтому волновые
свойства несущественны в механике
макроскопических тел. Для электронов
же с энергиями от 1 эВ до
10 000 эВ длина волны де Бройля лежит в
пределах от ~ 1 нм до 10−2 нм, то есть в
интервале длин волн рентгеновского
излучения.
Поэтому волновые свойства электронов
должны проявляться, например, при их
рассеянии на тех же кристаллах, на
которых наблюдается дифракция рентгеновских
лучей.[1]
Первое
подтверждение гипотезы де Бройля было
получено в 1927
году в
опытах американских физиков К.
Дэвиссона и
Л. Джермера. Пучок электронов ускорялся
в электрическом поле с разностью
потенциалов 100—150 В (энергия таких
электронов 100—150 эВ, что соответствует ![]() нм)
и падал на кристалл никеля,
играющий роль пространственной дифракционной
решётки.
Было установлено, что электроны
дифрагируют на кристалле, причём именно
так, как должно быть для волн, длина
которых определяется соотношением де
Бройля.[1]
нм)
и падал на кристалл никеля,
играющий роль пространственной дифракционной
решётки.
Было установлено, что электроны
дифрагируют на кристалле, причём именно
так, как должно быть для волн, длина
которых определяется соотношением де
Бройля.[1]
Подтвержденная
на опыте идея де Бройля о двойственной
природе микрочастиц — корпускулярно-волновом
дуализме —
принципиально изменила представления
об облике микромира. Поскольку всем
микрообъектам (за ними сохраняется
термин «частица») присущи и корпускулярные,
и волновые свойства, то, очевидно, любую
из этих «частиц» нельзя считать ни
частицей, ни волной в классическом
понимании. Возникла потребность в такой
теории, в которой волновые и корпускулярные
свойства материи выступали бы не как
исключающие, а как взаимно дополняющие
друг друга. В основу такой теории —
волновой, или квантовой,
механики —
и легла концепция де Бройля. Это отражается
даже в названии «волновая
функция»
для величины, описывающей в этой теории
состояние системы. Квадрат модуля
волновой функции определяет вероятность
состояния системы, и поэтому о волнах
де Бройля часто говорят[3]как
о волнах вероятности (точнее, амплитуд
вероятности). Для свободной частицы с
точно заданным импульсом p (и
энергией ![]() ),
движущейся вдоль оси x, волновая
функция имеет вид[1]:
),
движущейся вдоль оси x, волновая
функция имеет вид[1]:
![]()
где ![]() —
время,
—
время, ![]() .
.
В
этом случае ![]() ,
то есть вероятность обнаружить частицу
в любой точке одинакова.
,
то есть вероятность обнаружить частицу
в любой точке одинакова.
Корпускуля́рно-волново́й дуали́зм — принцип, согласно которому любой объект может проявлять как волновые, так и корпускулярные свойства. Как классический пример, свет можно трактовать как поток корпускул (фотонов), которые во многих физических эффектах проявляют свойства электромагнитных волн.
