
- •Сафу им. М.В.Ломоносова, иИиКт
- •10 Июня 2011 г.
- •Вопрос 1. Механическое движение. Система отсчёта. Путь, перемещение, траектория. Расчёт пути при равноускоренном движении.
- •Вопрос 2. Кинематика поступательного движения. Скорость мгновенная, средняя. Модуль скорости. Ускорение и его составляющие.
- •Вопрос 3. Кинематика вращательного движения. Элементарный угол поворота, угловая скорость, угловое ускорение. Связь линейных и угловых величин. Псевдовекторы.
- •Вопрос 4. Масса, свойство массы. Сила. Инерция. Первый закон Ньютона.
- •Вопрос 5. Сила. Импульс тела. Второй закон Ньютона. Принцип независимости сил. Третий закон Ньютона.
- •Вопрос 6. Импульс механической системы. Внешние силы. Замкнутая система. Закон сохранения импульса. Центр масс.
- •Вопрос 7. Работа силы в механике. Работа силы тяжести, работа силы упругости.
- •Вопрос 8. Кинетическая энергия – функция состояния системы. Теорема о кинетической энергии.
- •Вопрос 9. Силовое поле. Консервативные силы и диссипативные силы. Работа консервативных сил. Потенциальная энергия. Связь потенциальной энергии и консервативной силы.
- •Вопрос 10. Силовое поле. Потенциальное поле. Полная механическая энергия. Закон сохранения энергии.
- •Вопрос 11. Момент инерции материальной точки, твёрдого тела. Теорема Штейнера. Кинетическая энергия вращающегося тела.
- •Вопрос 12. Момент силы материальной точки относительно точки, момент силы материальной точки относительно оси. Основное уравнение динамики вращательного движения.
- •Вопрос 13. Момент импульса материальной точки относительно точки, момент импульса материальной точки относительно оси.
- •Вопрос 14. Момент импульса твердого тела. Закон сохранения момента импульса.
- •Вопрос 15. Параметры состояния. Термодинамическое равновесие. Модель идеального газа. Уравнение состояния идеального газа. Изопроцессы идеального газа.
- •Вопрос 16. Основное уравнение молекулярно-кинетической теории идеальных газов. Молекулярно-кинетическое толкование температуры. Средняя квадратичная скорость.
- •Вопрос 17. Закон Максвелла для распределения молекул идеального газа по скоростям. Анализ функции распределения.
- •Вопрос 18. Закон Максвелла для распределения молекул идеального газа по скоростям. Наиболее вероятная скорость.
- •Вопрос 19. Барометрическая формула. Распределение Больцмана.
- •Вопрос 20. Степени свободы молекул. Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия газа – функция состояния.
- •Вопрос 21. Первое начало термодинамики. Работа газа в адиабатном и изопроцессах.
- •Вопрос 22. Молекулярно-кинетическая теория теплоемкости идеальных газов. Недостатки классической теории теплоемкости идеальных газов.
- •Вопрос 23. Адиабатный и политропный процессы. Уравнение Пуассона.
- •Вопрос 24. Обратимые и необратимые процессы. Круговой процесс (цикл). Термический кпд цикла. Цикл Карно. Кпд цикла Карно.
- •Вопрос 25. Энтропия, её статистическое толкование и связь с термодинамической вероятностью. Расчет энтропии в процессах идеального газа.
- •Вопрос 26. Второе начало термодинамики. Второе начало термодинамики для необратимых процессов. Теорема Нернста.
- •Вопрос 27. Реальные газы. Уравнение Ван-дер-Ваальса и его анализ. Внутренняя энергия реального газа.
- •Вопрос 28. Постулаты Эйнштейна. Релятивистский импульс. Закон взаимосвязи массы и энергии.
- •Основные формулы.
- •1. Кинематика поступательного движения.
- •2. Кинематика поступательного и вращательного движения.
- •3. Динамика. Работа, энергия. Законы сохранения.
- •4. Динамика вращательного движения.
- •5. Динамика вращательного движения. Работа, энергия.
- •6. Теория относительности.
- •Молекулярная физика. Термодинамика Молекулярно-кинетическая теория
- •2. Распределение газовых молекул по скоростям
- •3. Элементы физической кинетики
- •4. Первое начало термодинамики. Внутренняя энергии. Работа и теплота
- •6. Второе начало термодинамики
Вопрос 16. Основное уравнение молекулярно-кинетической теории идеальных газов. Молекулярно-кинетическое толкование температуры. Средняя квадратичная скорость.
Основное уравнение МКТ устанавливает связь между макроскопическим параметром «давление» и параметрами, характеризующими молекулу.
При своем движении молекулы ударяются о стенки сосуда, в котором находятся, создавая, таким образом, давление.
Определим некоторые условия: давление не зависит от формы сосуда, газ находится в равновесии. Рассмотрим газ в кубическом сосуде со стороной a. Будем считать, что все молекулы движутся в трех направлениях. Если число молекул N, то вдоль каждой координатной оси движется n*1/3 молекул.
При движении одной молекулы применим ЗСИ для системы «молекула-стенка».

Сила
давления, которая возникает, равна
 .
Тогда
.
Тогда

 - за время
молекула пробегает расстояние 2a.
- за время
молекула пробегает расстояние 2a.
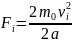

 В соответствии со статистическим
методом, нужно применить среднее значение
квадратичной скорости.
В соответствии со статистическим
методом, нужно применить среднее значение
квадратичной скорости.

не имеет смысла в применении к одной молекуле

Давление – это сила, разделенная на единицу площади.

Следствия:
 ,
,
 .
.
Средняя кинетическая энергия поступательного движения молекул зависит прямо пропорционально от термодинамической температуры, поэтому температура является мерой средней кинетической энергии молекул. Температура характеризует состояние теплового равновесия, это величина аддитивная.
Температура - физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В системе СИ разрешено использование термодинамической и практической шкалы температур. В термодинамической шкале тройная точка воды (температура, при которой лед, вода и пар при давлении 609 Па находятся в термодинамическом равновесии) считается равной Т = 273.16 градуса Кельвина [K]. В практической шкале температуры замерзания и кипения воды при давлении 101300 Па считаются равными, соответственно, t = 0 и t =100 градусов Цельсия [C]. Эти температуры связаны между собой соотношением
T = 273.15 + t.
Температура Т = 0 К называется нулем Кельвин, согласно современным представлениям эта температура недостижима, хотя приближение к ней сколь угодно близко возможно.
Из ОУМКТ можно получить формулу для расчета средней квадратичной скорости путем замены n=N/V, m=Nm0.

Вопрос 17. Закон Максвелла для распределения молекул идеального газа по скоростям. Анализ функции распределения.
В результате хаотического движения все молекулы газа движутся с разными скоростями. Но при этом средняя квадратичная скорость молекул газа, находящего в состоянии теплового равновесия при постоянной температуре, остается постоянной. Следовательно, в газе устанавливается стационарное распределение молекул по скоростям. Стационарное – независящее от времени. Этот закон на основе теории вероятности был выведен Максвеллом.
Если разбить весь диапазон скоростей молекул от 0 до бесконечности на малые интервалы dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v) имеющих скорость в этом интервале скоростей. Если всё число молекул равно N, то функция f(v) равная относительному числу молекул, скорости которых лежать в интервале от v до v+dv.
F(v)dv=
F(v)=

Относительное
число молекул
 определяет вероятность того, что число
молекул dN имеют скорости в интервале
от v до v+dv. Если допустим N=N0 то
F(v)dv=
вероятность того, что молекулы имеют
скорости в интервале dv, равна площади
трапеции, ограниченной на графике осью
v и графиком распределения.
Вся площадь под кривой равна интегралу
от функции распределения от 0 до ∞.
определяет вероятность того, что число
молекул dN имеют скорости в интервале
от v до v+dv. Если допустим N=N0 то
F(v)dv=
вероятность того, что молекулы имеют
скорости в интервале dv, равна площади
трапеции, ограниченной на графике осью
v и графиком распределения.
Вся площадь под кривой равна интегралу
от функции распределения от 0 до ∞.
 – условие нормировки.
– условие нормировки.
|
График функции имеют ярко выраженный
максимум. Скорость, при которой функция
распределения имеют максимум, пишется
Vв – вероятнейшая
скорость (наивероятнейшая) – скорость
которую имеет самое большое число
молекул. Vв= |
|
T1<T2. С увеличением температуры значение наивероятнейшей скорости увеличивается. Максимум кривой смещается вправо, т.к. площадь под кривой остаётся та же, то кривая будет растягиваться и пожаться. Число молекул, имеющих большие скорости, увеличивается. Распределение становится более равномерным.
|
M01 > M02. С увеличением массы молекулы или молярной массы газа максимум смещается в сторону меньших скоростей. Распределение Максвелла – наиболее вероятное распределение молекул по скоростям в условиях статистического равновесия. Температура, давление и концентрация молекул во всех точках пространства одинаковы. Это распределение определяет число частиц, которые обладают скоростями, лежащими в определенном интервале скоростей. Но нельзя сказать какая молекула, какой скоростью обладает в любой момент времени.



