
- •Сафу им. М.В.Ломоносова, иИиКт
- •10 Июня 2011 г.
- •Вопрос 1. Механическое движение. Система отсчёта. Путь, перемещение, траектория. Расчёт пути при равноускоренном движении.
- •Вопрос 2. Кинематика поступательного движения. Скорость мгновенная, средняя. Модуль скорости. Ускорение и его составляющие.
- •Вопрос 3. Кинематика вращательного движения. Элементарный угол поворота, угловая скорость, угловое ускорение. Связь линейных и угловых величин. Псевдовекторы.
- •Вопрос 4. Масса, свойство массы. Сила. Инерция. Первый закон Ньютона.
- •Вопрос 5. Сила. Импульс тела. Второй закон Ньютона. Принцип независимости сил. Третий закон Ньютона.
- •Вопрос 6. Импульс механической системы. Внешние силы. Замкнутая система. Закон сохранения импульса. Центр масс.
- •Вопрос 7. Работа силы в механике. Работа силы тяжести, работа силы упругости.
- •Вопрос 8. Кинетическая энергия – функция состояния системы. Теорема о кинетической энергии.
- •Вопрос 9. Силовое поле. Консервативные силы и диссипативные силы. Работа консервативных сил. Потенциальная энергия. Связь потенциальной энергии и консервативной силы.
- •Вопрос 10. Силовое поле. Потенциальное поле. Полная механическая энергия. Закон сохранения энергии.
- •Вопрос 11. Момент инерции материальной точки, твёрдого тела. Теорема Штейнера. Кинетическая энергия вращающегося тела.
- •Вопрос 12. Момент силы материальной точки относительно точки, момент силы материальной точки относительно оси. Основное уравнение динамики вращательного движения.
- •Вопрос 13. Момент импульса материальной точки относительно точки, момент импульса материальной точки относительно оси.
- •Вопрос 14. Момент импульса твердого тела. Закон сохранения момента импульса.
- •Вопрос 15. Параметры состояния. Термодинамическое равновесие. Модель идеального газа. Уравнение состояния идеального газа. Изопроцессы идеального газа.
- •Вопрос 16. Основное уравнение молекулярно-кинетической теории идеальных газов. Молекулярно-кинетическое толкование температуры. Средняя квадратичная скорость.
- •Вопрос 17. Закон Максвелла для распределения молекул идеального газа по скоростям. Анализ функции распределения.
- •Вопрос 18. Закон Максвелла для распределения молекул идеального газа по скоростям. Наиболее вероятная скорость.
- •Вопрос 19. Барометрическая формула. Распределение Больцмана.
- •Вопрос 20. Степени свободы молекул. Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия газа – функция состояния.
- •Вопрос 21. Первое начало термодинамики. Работа газа в адиабатном и изопроцессах.
- •Вопрос 22. Молекулярно-кинетическая теория теплоемкости идеальных газов. Недостатки классической теории теплоемкости идеальных газов.
- •Вопрос 23. Адиабатный и политропный процессы. Уравнение Пуассона.
- •Вопрос 24. Обратимые и необратимые процессы. Круговой процесс (цикл). Термический кпд цикла. Цикл Карно. Кпд цикла Карно.
- •Вопрос 25. Энтропия, её статистическое толкование и связь с термодинамической вероятностью. Расчет энтропии в процессах идеального газа.
- •Вопрос 26. Второе начало термодинамики. Второе начало термодинамики для необратимых процессов. Теорема Нернста.
- •Вопрос 27. Реальные газы. Уравнение Ван-дер-Ваальса и его анализ. Внутренняя энергия реального газа.
- •Вопрос 28. Постулаты Эйнштейна. Релятивистский импульс. Закон взаимосвязи массы и энергии.
- •Основные формулы.
- •1. Кинематика поступательного движения.
- •2. Кинематика поступательного и вращательного движения.
- •3. Динамика. Работа, энергия. Законы сохранения.
- •4. Динамика вращательного движения.
- •5. Динамика вращательного движения. Работа, энергия.
- •6. Теория относительности.
- •Молекулярная физика. Термодинамика Молекулярно-кинетическая теория
- •2. Распределение газовых молекул по скоростям
- •3. Элементы физической кинетики
- •4. Первое начало термодинамики. Внутренняя энергии. Работа и теплота
- •6. Второе начало термодинамики
Вопрос 21. Первое начало термодинамики. Работа газа в адиабатном и изопроцессах.
Первое начало термодинамики: количество теплоты, сообщенное системе, идет на изменение внутренней энергии системы и на совершение системой работы против внешних сил.

 >0,
если система нагревается.
>0,
если система нагревается.
Работа и теплота зависит от процесса. Работа совершается при изменении объема газа. Работа в термодинамике – обобщенная форма обмена энергией между системой и окружающей средой, в результате чего происходит изменение внешних параметров. Рассчитывает работу. Будем считать, что в сосуде под поршнем находится газ.
Будем считать, что газ двигает поршень очень медленно, что давление внутри газа постоянно. Тогда сила F=pS.
Работа




Работа в изопроцессах
Изотермический (T = const, δA = pdV (δA – элементарная работа))

Изобарный (p = const)

Изохорный
(V = const, ∆V
= 0)

Адиабатный (∆Q = 0)



Во всех процессах:
Вопрос 22. Молекулярно-кинетическая теория теплоемкости идеальных газов. Недостатки классической теории теплоемкости идеальных газов.
Теплоемкость – количество теплоты, которое нужно сообщить телу для изменения его температуры на 1 К.
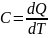

Удельная теплоемкость – теплоемкость единицы массы.


Молярная теплоемкость – количество теплоты, необходимое для изменения температуры на 1 К 1 моль вещества.


Изотермический - при изотермическом процессе теплоемкость равна ∞ (бесконечность), т.е. сколько бы мы не нагревали газ, не произойдет изменение температуры.
Адиабатный - теплоемкость равна 0.
Изохорный
(V = const, ∆Q
= dU, dA=pdV=0)
 - молярная теплоемкость при изохорном
процессе
- молярная теплоемкость при изохорном
процессе
Изобарный
(p = const,
 )
)
 - молярная теплоемкость при изобарном
процессе
- молярная теплоемкость при изобарном
процессе
 – уравнение Майера, смысл газовой
постоянной R – универсальная
газовая постоянная равная работе,
которую совершает 1 моль газа при
нагревании его на 1 К.
– уравнение Майера, смысл газовой
постоянной R – универсальная
газовая постоянная равная работе,
которую совершает 1 моль газа при
нагревании его на 1 К.


 - коэффициент Пуассона
- коэффициент Пуассона
|
1.67 |
1.4 |
1.33 |
|
3 |
5 |
6 |
Классическая теория теплоемкости устанавливает, что теплоемкости зависят только от процесса, и поэтому являются одинаковым для одноатомных, двухатомных, и т.д. газов.
Теплоемкость не зависит от температуры. Такая теория хорошо согласуется с практическими результатами для одно- и двухатомных газов при невысоких температурах, в пределах 400 К. При более высоких температруах наблюдается зависимость теплоемкости от температуры. Трудности классической теории теплоёмкости преодолены квантовой теорией теплоемкости.
Вопрос 23. Адиабатный и политропный процессы. Уравнение Пуассона.
Адиабатным
называется процесс, при котором
отсутствует теплообмен ( )
между системой и окружающей средой.
)
между системой и окружающей средой.
Выведем уравнение адиабаты:










При адиабатном процессе работа совершается только за счёт убыли внутренней энергии. При расширении газа работа «+». Связь между давлением и объёмом в адиабатном процессе:
Если

В современной технике адиабатические процессы имеют очень большое значение, для получения сверхнизких/сверхвысоких температур. Адиабатные процессы проводят или очень быстро или осуществляют их в теплоизоляционных оболочках.
Политропный
процесс – процесс, проходящий с постоянной
теплоемкостью.
 - уравнение политропности.
- уравнение политропности.
n=0, p=const
n=1,
t=const
n=
,
=0
n=+- ,
V=const
,
V=const

